
| ������ | I2�����ʵ�����mol�� | ������ | I2�����ʵ�����mol�� |
| H2O2 | IO3- | ||
| MnO4- | HNO2 |
���� ��1����Ӧ��I-��I2��ʧȥ1�����ӣ���H2O2��H2O�õ�2�����ӣ�IO3-��I2�õ�5�����ӣ�MnO4-��Mn2+�õ�5�����ӣ�HNO2��NO�õ�1�����ӣ�����������ԭ��Ӧ�������뻹ԭ����ʧ������Ŀ��Ƚ����жϣ�
��2������ijŨ�ȵ����ᷴӦʱ����ת��Ϊ�����ʵ�����Fe2+��Fe3+����Ԫ�ػ��ϼ����ߣ������е�Ԫ�ػ��ϼ۽��ͣ����ݵ����غ��������Ļ�ԭ�����е�Ԫ�صĻ��ϼۼ��ɣ�
��� �⣺�ֱ���1mol��Щ��������������KI������ʱI-ʧ���ӳ�Ϊ�ⵥ�ʣ�����1mol���ʵ⣬ת�Ƶ�����2mol��H2O2��H2O�õ�2�����ӣ����ɵⵥ����1mol��IO3-��I2�õ�5�����ӣ�ͬʱ�����ӳ�Ϊ�ⵥ�ʣ��������ɵⵥ����3mol��MnO4-��Mn2+�õ�5�����ӣ�HNO3��NO�õ�3�����ӣ����ɵⵥ����2.5mol��I-��I2��ʧȥ1�����ӣ����ɵⵥ����0.5mol���ʴ�Ϊ��
| ������ | I2�����ʵ�����mol�� | ������ | I2�����ʵ�����mol�� |
| H2O2 | 1 | IO3- | 3 |
| MnO4- | 2.5 | HNO2 | 0.5 |
���� ���⿼��ѧ��������ԭ��Ӧ�е����غ���йؼ���֪ʶ�������ۺ�֪ʶ�Ŀ��飬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij����С���о��������������������£��ı���ʼ���������ʵ���[��n��H2����ʾ]��N2��g��+3H2��g��?2NH3��g����Ӧ��Ӱ�죬ʵ�����ɱ�ʾ����ͼ��ʾ�Ĺ��ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
ij����С���о��������������������£��ı���ʼ���������ʵ���[��n��H2����ʾ]��N2��g��+3H2��g��?2NH3��g����Ӧ��Ӱ�죬ʵ�����ɱ�ʾ����ͼ��ʾ�Ĺ��ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����0.1 mol•L-1��Na2SO3��Һ490mL������500ml����ƿ | |
| B�� | ��2�ȷݲ����͵��ռ���Һ�зֱ����һ������Na2O2��Na2O��ʹ��Һ��ǡ�ñ��ͣ�������Na2O2��Na2O�����ʵ���֮�ȵ���1��1�������¶Ȳ��䣩 | |
| C�� | �ڱ�״���£���22.4L��������1Lˮ�У��õ�1mol•L-1�İ�ˮ | |
| D�� | 10mL��������Ϊ70%���Ҵ���10mLˮϡ�ͺ��Ҵ�����������С��35% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | FeCl3��Һ��ͨ��SO2����Һ��ɫ��ȥ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | |
| B�� | 90��ʱ����ô�ˮ��c��H+��•c��OH-��=3.8��10-13��H2O��l��?H+��aq��+OH-��aq����H��0 | |
| C�� | ��ˮ�е����̪��Һ����Һ��죺NH3•H2O=NH4++OH- | |
| D�� | ������Һ��ͨ��CO2����Һ����ǣ�2C6H5ONa+CO2+H2O��2C6H5OH+Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ױ�������ԭ�Ӷ�����ͬһƽ���� | |
| B�� | �������ϩ��������������Ӧ | |
| C�� | ���Ը��������Һ�����������ͼ��� | |
| D�� | ��ϩ���������������ӳɷ�Ӧ���������������ӳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
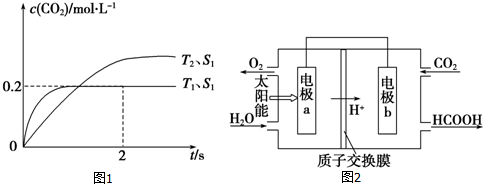
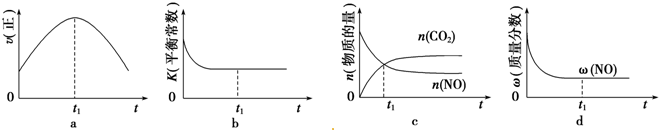
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com