
分析 (1)①Cr2O72-为有色离子;
②pH=11的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
③水电离出H+浓度为10-3mol/L溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应,碳酸根离子与氢离子反应;
④使甲基橙变黄的溶液呈酸性或碱性,铁离子与氢氧根离子反应;
⑤某澄清溶液中,四种离子之间不反应,能够共存;
(2)二价铁离子还原性强于溴离子,氯气不足时氯气先氧化二价铁离子,再氧化溴离子;
(3)开始时硫酸氢钠不足,反应生成硫酸钡沉淀、氢氧化钠和水;
(4)开始时氢氧化钡不足,离子方程式按照氢氧化钡的化学式组成书写;
生成的沉淀物质的量最多时,铝离子恰好完全反应生成硫酸钡、氢氧化铝,结合铝离子的物质的量计算氢氧化铝、硫酸钡的物质的量.
解答 解:(1)①无色溶液中不会存在有色的Cr2O72-离子,故①错误;
②pH=11的溶液呈碱性,溶液中存在大量氢氧根离子,CO32-、Na+、AlO2-、NO3-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③水电离出H+浓度为10-3mol/L溶液呈酸性或碱性,NH4+与氢氧根离子反应,CO32-与氢离子反应,在溶液中一定不能大量共存,故③错误;
④使甲基橙变黄的溶液中存在大量氢离子或氢氧根离子,Fe3+与氢氧根离子反应,在碱性溶液中不能大量共存,故④错误;
⑤Na+、H+、SO42-、MnO4-之间不反应,为澄清透明溶液,在溶液中能够大量共存,故⑤正确;
故答案为:②⑤;
(2)向FeBr2溶液中通入等物质的量的氯气,氯气不足,亚铁离子优先反应,剩余的氯气再氧化溴离子,反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,
故答案为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;
(3)将NaHSO4溶液逐滴滴入Ba(OH)2溶液中,刚开始时硫酸氢钠不足,反应生成硫酸钡、氢氧化钠和水,反应的离子方程式是:H++SO42-+Ba2++OH-=BaSO4↓+H2O,
故答案为:H++SO42-+Ba2++OH-=BaSO4↓+H2O;
(4)向200mL 1mol/L的明矾溶液中逐渐滴加同浓度的Ba(OH)2溶液,开始阶段氢氧化钡不足,反应生成氢氧化铝和硫酸钡沉淀,反应的离子方程式是:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓;
生成的沉淀物质的量最多时,反应生成硫酸钡、氢氧化铝,发生的离子反应为:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,200mL 1mol/L的明矾溶液中含有铝离子的物质的量为:1mol/L×0.2L=0.2mol,则生成沉淀的最大物质的量为:0.2mol+0.2mol×$\frac{3}{2}$=0.5mol,
故答案为:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓;0.5mol.
点评 本题考查较为综合,涉及离子共存、离子方程式书写,题目难度中等,明确离子反应发生条件为解答关键,注意掌握离子共存的条件,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 容量瓶未经干燥不能用来配制溶液 | |
| B. | 用铁坩埚灼烧烧碱 | |
| C. | 中和热的测定实验中用环形玻璃棒搅拌 | |
| D. | 加热蒸发皿时不用石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K+、CO32-、SO42- | B. | Fe3+、Na+、NO3-、SO42- | ||
| C. | Mg2+、Ba2+、OH-、NO3- | D. | K+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰溶于水;锌粒和稀硫酸反应 | |
| B. | 稀释浓硫酸;金属或金属氧化物熔化 | |
| C. | 氢氧化钠和盐酸反应;二氧化碳和碳反应 | |
| D. | 工业煅烧石灰石;化石燃料燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
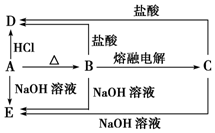 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com