
分析 (1)根据盖斯定律,将两个热化学方程式相加即可得到碳燃烧的热化学方程式;
(2)根据(1)可知碳的燃烧热,然后根据“1.00molCaCO3生成CaO和CO2,需吸收约180kJ的热量“计算出煅烧10.0molCaCO3所需燃烧C的物质的量.
解答 解:(1)①C(s)+($\frac{1}{2}$)O2(g)=CO(g)△H≈-115KJ/mol,
②CO(g)+($\frac{1}{2}$)O2(g)=CO2(g)△H≈-285KJ/mol,
根据盖斯定律,①+②可得:C(s)+O2(g)=CO2(g)△H=-400kJ/mol,
故答案为:C(s)+O2(g)=CO2(g)△H=-400kJ/mol;
(2)碳燃烧的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-400kJ/mol,则碳的燃烧热为400kJ/mol,煅烧10.0molCaCO3吸收的热量为180kJ×$\frac{10.0mol}{1.0mol}$=1800kJ,煅烧该石灰石需要消耗C的物质的量为$\frac{1800kJ}{400kJ/mol}$=4.5mol,
答:煅烧10.0molCaCO3所需燃烧C的物质的量4.5mol.
点评 本题考查了反应热的计算,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,注意掌握热化学方程式的书写原则及表示意义,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在相同条件下,将等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 由 C(s,石墨)→C(s,金刚石)-1.9kJ可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+57.3kJ,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)→2H2O(l)+285.8kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同 | B. | H2SO4溶液消耗的NaOH多 | ||
| C. | HCl溶液消耗的NaOH多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强 A转化率 温度 | P1(MPa) | P2(MPa) |
| 400℃ | 96 | 99 |
| 500℃ | 96 | 97 |
| A. | 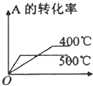 | B. | 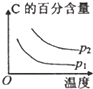 | C. | 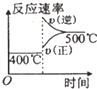 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com