
| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性氧化物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. | 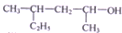 的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{238}$Pu的质子数为94,中子数为238,电子数为144 |
分析 A.水溶液中或熔融状态下完全电离的电解质为强电解质;
B.和酸反应生成盐和水的氧化物为碱性氧化物,和碱反应生成盐和水的氧化物为酸性氧化物,发生的都不是氧化还原反应;
C.选取含连醇羟基碳原子在内的最长碳链,从离羟基近的一端开始编号,写出名称,注意要写出官能团、支链的位置和名称;
D.原子符号中质子数+中子数=质量数,计算分析判断.
解答 解:A.HBr、KOH、CaCO3水溶液中或熔融状态完全电离都是强电解质,H2O部分电离属于弱电解质,故A错误;
B.Na2O2和酸反应生成盐、水和氧气,不是碱性氧化物,CaO是碱性氧化物,Al2O3和酸碱都反应,属于两性氧化物,SiO2、SO2都和碱反应生成盐和水是酸性氧化物、NO2 和碱反应发生的是氧化还原反应,不是酸性氧化物,故B错误;
C.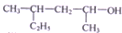 依据命名方法得当名称为4-甲基-2-己醇,故C正确;
依据命名方法得当名称为4-甲基-2-己醇,故C正确;
D.${\;}_{94}^{238}$Pu的质子数为94,中子数=238-94=144,电子数为94,故D错误;
故选C.
点评 本题考查了物质分类、有机物命名、原子结构等知识点,主要是强电解质、酸性氧化物、碱性氧化物概念的理解应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 | |
| D. | 根据步骤Ⅱ可以得出,m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
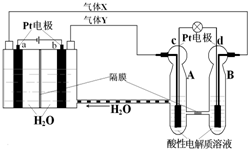 RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )| A. | c电极发生还原反应,B池中H+通过隔膜进入A池 | |
| B. | b电极上发生的电极反应是:2H2O+2e-═H2↑+2OH- | |
| C. | 转移0.1mol电子时,a电极产生标准状况O21.12L | |
| D. | d电极上发生的电极反应是:O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
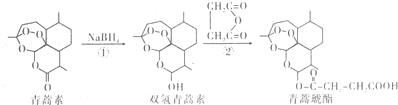
| A. | 青蒿素分子中所有碳原子在同一平面内 | |
| B. | 反应①属于还原反应,反应②理论上原子利用率可达100% | |
| C. | 双氢青蒿素属于芳香化合物 | |
| D. | 青蒿琥酯可以发生水解、酯化以及加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
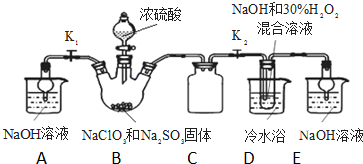 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1 | |
| D. | 当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
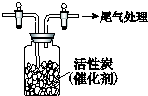 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com