
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③>①>② | D. | 最高化合价:②>①>③ |
分析 由①1s22s22p63s23p4、②1s22s22p63s23p3、③1s22s22p5可知,由①为S,②为P,③为F,非金属性越强,电负性越大、第一电离能越大,但P的3p电子半满为稳定结构,以此来解答.
解答 解:由电子排布可知,①为S,②为P,③为F,
A.非金属性越强,第一电离能越大,但P的3p电子半满为稳定结构,则第一电离能:③>②>①,故A正确;
B.电子层越大,原子半径越大,同周期从左向右原子半径减小,则原子半径:②>①>③,故B错误;
C.非金属性越强,电负性越大,则电负性:③>①>②,故C正确;
D.F无正价,最高正价等于最外层电子数,则最高化合价:①>②>③,故D错误;
故选AC.
点评 本题考查原子结构与元素周期律,为高频考点,把握电子排布规律推断元素、元素周期律为解答该题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:选择题
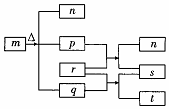 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径:Z>Y>X | B. | 最简单气态氢化物的稳定性:Y>X | ||
| C. | m、n、r都含有离子键和共价键 | D. | m、n、t都能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 除杂试剂 | 实验方法 |
| A | 除去CuCO3固体中的(NH4)2CO3 | - | 置于坩埚中加热至恒重 |
| B | 除去Ag2S中少量AgCl | Na2S溶液 | 过滤 |
| C | 除去乙稀中的SO2气体 | 酸性高锰酸钾溶液 | 洗气 |
| D | 除去甘油中的乙酸 | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有主族中都有非金属元素 | |
| B. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| C. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| D. | 元素周期表中从ⅢB到ⅡB 10个纵列的元素都是金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com