
| A. | 向次氯酸钙溶液中通入过量的二氧化硫:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ | |
| B. |  溶液中加入过量的碳酸钠: 溶液中加入过量的碳酸钠: | |
| C. | 硝酸铁溶液中加入少量的氢碘酸2NO3-+8H++6I-=3I2+2NO+4H2O | |
| D. | NH4Al(SO4)2溶液中加入少量的氢氧化钠溶液NH4++Al3++4OH-=NH3↑+Al(OH)3↓+H2O |
分析 A.向次氯酸钙溶液中通入过量的二氧化硫,亚硫酸盐不可能存在次氯酸溶液中,要发生氧化还原反应;
B.酚羟基和羧基都与碳酸钠反应,反应生成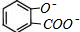 和碳酸氢钠;
和碳酸氢钠;
C.碘化氢少量,硝酸根离子在酸性条件下具有强氧化性,优先参与反应,铁离子没有反应;
D.氢氧化钠少量,只有铝离子反应,铵根离子不参与反应.
解答 解:A.向次氯酸钙溶液中通入过量的二氧化硫,亚硫酸盐不可能存在次氯酸溶液中,要发生氧化还原反应,正确的离子方程式为:2ClO-+Ca2++2H2O+2SO2=2Cl-+CaSO4↓+4H++SO42-,故A错误;
B. 溶液中加入过量的碳酸钠,反应生成
溶液中加入过量的碳酸钠,反应生成 ,正确的离子方程式为:
,正确的离子方程式为: +2CO32-→
+2CO32-→ +2HCO3-,故B错误;
+2HCO3-,故B错误;
C.硝酸铁溶液中加入少量的氢碘酸,二者发生氧化还原反应,反应的离子方程式为:2NO3-+8H++6I-=3I2+2NO↑+4H2O,故C正确;
D.NH4Al(SO4)2溶液中加入少量的氢氧化钠溶液,铝离子优先反应,正确的离子方程式为:Al3++3OH-=Al(OH)3↓,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等,B为易错点,注意酚羟基和羧基都能够与碳酸钠反应.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S Na2O Na2SO3 | B. | Na2SO4Na2O Na2SO3 | ||
| C. | Na2O Na2S Na2SO4 | D. | Na2S Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组欲探究己烷的性质,用己烷进行下利实验:
某化学学习小组欲探究己烷的性质,用己烷进行下利实验:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ⅰ实验结果 | Ⅱ回答问题 |
| ①取原溶液少许,滴加足量氯水,产生沉淀;过滤,滤液加CCl4,振荡后,CCl4层未变色. | ①该步实验说明溶液中不存在Br-离子I-. |
| ②取原溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色. | ②该步实验发生反应的离子方程式为 8H++2NO3-(稀)+3Cu=3Cu2++2NO↑+4H2O. |
| ③取原溶液少许,加盐酸酸化后,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失. | ③产生白色沉淀的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+. |
| ④取原溶液少许,滴加2滴酸性高锰酸钾溶液,紫色立即褪去. | ④该步实验说明溶液中存在SO32-离子. |
| ⑤取原溶液少许,加足量Ba(NO3)2溶液产生白色沉淀,过滤;往洗涤后的沉淀中加入足量盐酸,沉淀部分溶解,有无色气体产生. | ⑤未溶解的白色沉淀是BaSO4;将气体通入品红溶液的现象是品红溶液褪色. |
| ⑥取步骤⑤所得滤液,加HNO3酸化后,再加AgNO3溶液,溶液中析出白色沉淀. | ⑥该步骤是否有意义有(填“有”或“无”). |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2H2O+O2↑,铁离子会加速H2O2分解,使洗涤剂失去杀菌作用;2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,Fe3+与CO32-水解相互促进,使洗涤剂失去去污能力.
2H2O+O2↑,铁离子会加速H2O2分解,使洗涤剂失去杀菌作用;2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,Fe3+与CO32-水解相互促进,使洗涤剂失去去污能力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用含1mol FeCl3的溶液制备成Fe(OH)3胶体,其中胶粒数为NA | |
| B. | 12g金刚石中含有的共价键数为4 NA | |
| C. | 常温常压下,14 g CO和N2的混合气体中,含有原子数为NA | |
| D. | 1 L 1 mol/L NH4Cl溶液中含有NH4+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H=-485 kJ/mol | B. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═+485 kJ/mol | ||
| C. | 2H2(g)+O2 (g)═2H2O(g)△H=+485 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=-485 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com