
| A. | 盐酸和氢氧化钠溶液混合 | B. | 灼热的木炭与二氧化碳反应 | ||
| C. | 锌放入稀硫酸中 | D. | 碳不完全燃烧生成一氧化碳 |
科目:高中化学 来源: 题型:解答题
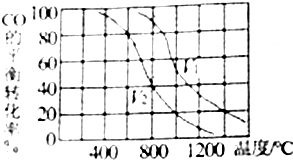
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
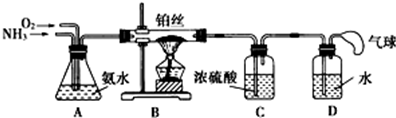
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中不能用粥汤检验碘盐中是否含有KIO3 | |
| B. | 减压过滤更适宜过滤胶状沉淀和颗粒较小的沉淀 | |
| C. | 通常用直接蒸馏的方法除去乙醇中的水 | |
| D. | 洗涤沉淀时,应用玻璃棒轻轻搅拌,使沉淀表面上的杂质溶于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

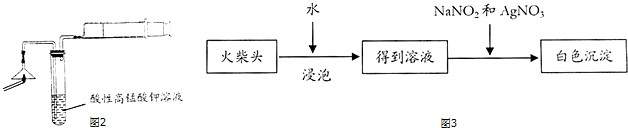
| 实验次数 | H2O2溶液质量分数% | H2O2溶液用量/毫升 | 物质D用量/克 | 反应温度/℃ | 收集气体体积/毫升 | 所需时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
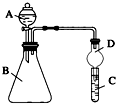 某同学为探究元素周期表中元素性质的递变规律,设计如图系列实验:
某同学为探究元素周期表中元素性质的递变规律,设计如图系列实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料电池是一种高效、环境友好的新型电池 | |
| B. | 铅蓄电池放电的时候:正极是Pb,负极是PbO2 | |
| C. | 镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 | |
| D. | 原电池正极发生的反应是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| B. | 硫酸铝与氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 氯气与氢氧化钾溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 小苏打溶液与稀盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com