
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: .
考点: 用盖斯定律进行有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 根据盖斯定律将三个化学方程式进行处理.
解答: 解:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3﹣②﹣③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(﹣24.8kJ/mol)×3﹣(﹣47.2kJ/mol)﹣(+640.5kJ/mol)×2=﹣1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=﹣218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=﹣218.0kJ/mol.
点评: 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用.下列说法不正确的是()
A. 铝盐(明矾溶液)和铁盐(硫酸铁溶液)都有净水作用,两者的作用原理是相同的
B. 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
C. 0.1mol/L的CH3COONa溶液的pH约为9,说明CH3COOH是弱酸
D. 室温下向10mLpH=3的醋酸溶液中加入水稀释后,溶液中导电粒子的数目减少
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组原子,彼此性质一定相似的是( )
A. 1s2与2s2的元素
B. M层上有两个电子与N层上有两个电子的元素
C. 2p上有一个未成对电子与3p上有一个未成对电子的元素
D. L层上有一个空轨道和M层的p轨道上有一个空轨道的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,下列各组热化学方程式中,Q2>Q1的是()
A. 2H2(g)+O2(g)=2H2O(g)△H=﹣Q1kJ/mol;
2H2(g)+O2(g)=2H2O(g))△H=﹣Q2kJ/mol
B. S(g)+O2(g)=SO2(g)△H=﹣Q1kJ/mol;
S(s)+O2(g)=SO2(g))△H=﹣Q2kJ/mol
C. C(s)+ O2(g)=CO2(g))△H=﹣Q1kJ/mol;
O2(g)=CO2(g))△H=﹣Q1kJ/mol;
C(s)+O2(g)=CO(g))△H=﹣Q2kJ/mol
D. H2(g)+Cl2(g)=2HCl(g)△H=﹣Q1kJ/mol;
 H2(g)+Cl2(g)=HCl(g))△H=﹣Q2kJ/mol
H2(g)+Cl2(g)=HCl(g))△H=﹣Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
有一环保汽车,是以氢气作燃料的,请按题目要求作答:
(1)氢气在发动机内燃烧过程中,生成物只有水蒸气,不会使空气中的 含量偏高,因而能减缓温室效应现的发生.
(2)如果每mol氢气燃烧后生成水蒸气并放出241.8kJ的热量,写出氢气燃烧的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为()
A. 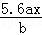 B.
B. 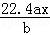 C.
C. 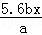 D.
D. 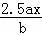
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是()

A. 铅笔端作阳极,发生还原反应
B. 铂片端作阴极,发生氧化反应
C. 铅笔端有少量的氯气产生
D. a点是负极,b点是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去。
(1)硫元素的原子结构示意图为 ;羰基硫分子的电子式为 。
(2)下列说法正确的是 。
a. 乙硫醇的相对分子质量大于乙醇,故其沸点更高
b. 同温度同浓度下Na2CO3溶液的pH大于Na2SO4溶液,说明硫元素非金属性强于碳元素
c. H2S分子和CO2都是极性分子,因为它们都是直线形分子
d. 由于乙基的影响,乙硫醇的酸性弱于H2S
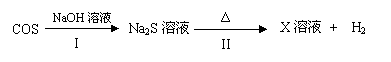 (3)羰基硫用氢氧化钠溶液处理及利用的过程如下(部分产物已略去):
(3)羰基硫用氢氧化钠溶液处理及利用的过程如下(部分产物已略去):
①反应I除生成两种正盐外,还有水生成,其化学方程式为 。
②已知X溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为 。
③右图是反应II中,在不同反应温度下,反应时间与H2产量的关系图
(Na2S初始含量为3 mmo1)。
a. 判断T1、T2、T3的大小: ;
b. 在T1温度下,充分反应后,若X溶液中除S2O32-外,还有因发生副反应而同时产生的SO42-,则溶液中c(S2O32-):c(SO42-)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com