
| A. | SO3 | B. | N2O5 | C. | Na2O | D. | CO2 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
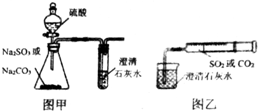 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
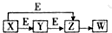 如图是某常见元素M的单质及其化合物间的转化关系图,其中X、Y、Z、W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( )
如图是某常见元素M的单质及其化合物间的转化关系图,其中X、Y、Z、W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( )| A. | W可能是硫酸 | B. | Y不可能是Mg | C. | X可能是钠 | D. | Z可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制造光导纤维 | |
| B. | SiO2是酸性氧化物,不溶于任何酸 | |
| C. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| D. | 石灰石是生产玻璃和水泥的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物的研究在无机化学的发展中占有独特的地位.
硼及其化合物的研究在无机化学的发展中占有独特的地位. H++B(OH)4-
H++B(OH)4-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
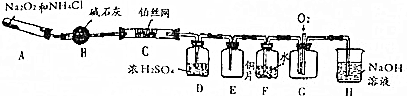
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com