
 3-甲基-1-丁烯
3-甲基-1-丁烯 3-甲基-2-丁醇.
3-甲基-2-丁醇. 科目:高中化学 来源: 题型:解答题
 ,在过氧化钠晶体中阴、阳离子的个数比为1:2;
,在过氧化钠晶体中阴、阳离子的个数比为1:2;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是D
(1)在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是D查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2发生氧化反应 | B. | 碘电极为该电池的负极 | ||
| C. | 正极反应为:Li-e-═Li+ | D. | 该电池放电时化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
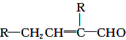 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下: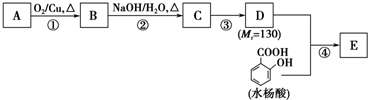
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com