

分析 (1)Li3N固体水解生成氢氧化锂和氨气的反应制氨气,不需要加热;
(2)为检验氨气还原氧化铜反应后生成Cu、H2O、N2,首先干燥氨气,然后氨气还原氧化铜,再用无水硫酸铜检验产物H2O,再除去氨气,最后用排水法收集氮气;
(3)常用碱石灰干燥氨气;用无水硫酸铜检验水;
(4)在酸性条件下,Cu2O自身发生氧化还原反应生成Cu2+;依此设计C处的红色固体中是否含有Cu2O,加入过量稀硫酸,充分反应,若试管内同时有蓝色溶液和红色固体,则证明含有Cu2O;
(5)实验完毕后,测得收集到的氮气体积为a L(已折算为标注状况),根据反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,求算氧化铜的物质的量,甲烷还原氧化铜的原理是:CH4+4CuO$\stackrel{△}{→}$CO2+2H2O+4Cu,据此求算消耗甲烷的物质的量,依此求算出标况下的体积.
解答 解:(1)Li3N固体水解生成氢氧化锂和氨气的反应制氨气,不需要加热,应选A为氨气的发生装置,故答案为:A;
(2)根据题给的要求为检验氨气还原氧化铜反应后生成Cu、H2O、N2,应该先对产生的氨气进行干燥,即选择E装置,然后进行实验,选择E装置检验水,再除去氨气,最后用排水法收集氮气,即正确的操作顺序为:E、C、E、B、F,
故答案为:E.E.B.F;
(3)常用碱石灰干燥氨气;用无水硫酸铜检验水,
故答案为:碱石灰、无水硫酸铜;
(4)在酸性条件下,Cu2O自身发生氧化还原反应生成Cu2+,离子方程式为:Cu2O+2H+=Cu++Cu2++H2O,若证明C处的红色固体中是否含有Cu2O,待反应后,取硬质玻璃管中红色固体少许于试管中,加入过量稀硫酸,充分反应,若试管内同时有蓝色溶液和红色固体,则证明含有Cu2O,
故答案为:待反应后,取硬质玻璃管中红色固体少许于试管中,加入过量稀硫酸,充分反应,若试管内同时有蓝色溶液和红色固体,则证明含有Cu2O;
(5)实验完毕后,测得收集到的氮气体积为a L(已折算为标注状况),根据反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,氧化铜的物质的量是$\frac{3a}{22.4}$mol,甲烷还原氧化铜的原理是:CH4+4CuO$\stackrel{△}{→}$CO2+2H2O+4Cu,则消耗甲烷的物质的量是$\frac{0.75a}{22.4}$mol,标况下的体积是0.75a,
故答案为:0.75a.
点评 本题考查氨气还原氧化铜的实验探究,注意分析题给的条件,知道浓硫酸和碱石灰的作用,为了用纯净、干燥的氨气还原氧化铜,为检验氨气还原氧化铜反应后生成H2O,要注意先除去氨气中的杂质,即除去水,题目难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
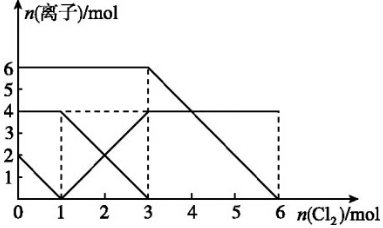
| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为3 mol | |
| C. | 当通入1mol Cl2时,溶液中已发生的反应为2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Fe2+ | B. | H+ | C. | Cu2+ Fe3+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 加入盐酸的体积 | 沉淀质量 |
| 1 | 60mL | 0 |
| 2 | 80mL | 0.78g |
| 3 | 180mL | 5.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl原子的结构示意图: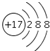 | |
| B. | 乙酸的结构式:C2H4O2 | |
| C. | 氯化氢分子的电子式: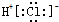 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com