
【题目】下列哪种方法不能实现海水的淡化( )
A. 蒸馏法 B. 电渗析法 C. 离子交换法 D. 电解法
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1. 6mol Fe,充分反应(已知NO![]() 被还原为NO)。下列说法正确的是( )
被还原为NO)。下列说法正确的是( )
A. 被还原的硝酸是1.25mol
B. 所得溶液中c(Fe2+)∶c(Fe3+)=1∶1
C. 所得溶液中n(NO3-)=2.75 ,该溶液含还可溶解铁0.375mol.
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④B.①③④②
C.③④②①D.③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、 MgSiO3以及铁和铝的氧化物)为原料制备MgCO33H2O。实验流程如下: [已知当溶液的pH=8.5时, Mg(OH)2开始沉淀]

(1)滤渣的主要成分是______(填化学式)。
(2)氧化的目的是__________。
(3)由氧化后得到的溶液经除杂后,滴加适量的Na2CO3溶液便可制得MgCO33H2O。滴加Na2CO3溶液时,不能太快也不能过量的原因是_______________。
(4)通过测定产品中的镁含量和碳含量可判断质量的优劣。现称取3.00 g某学生制得的产品溶于足量的稀盐酸中收集到448 mLCO2气体(假设气体全部逸出并折算为标准状况 ),再将所得溶液稀释至250 mL,取 出25 mL,向其中滴加0.1000 mol·L-1的EDTA(Na2H2Y)溶液至恰好完全反应时消耗体积为23.10 mL。(离子方程式为Mg2++H2Y2-=MgY2-+2H+)通过计算,分别确定镁含量和碳含量比理论值偏高还是偏低?_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置图制取并收集干燥的氯气. 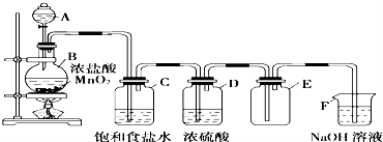
回答下列问题:
(1)装置C的作用是 , 装置D的作用是 .
(2)装置F的作用是 .
(3)装置B中,如果反应产生氯气的体积为2.24L(标准状况),则反应中被氧化的HCl 的 物质的量为 .
(4)写出圆底烧瓶中发生的化学方程式: .
(5)F处发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是
A. 16 g B. 32 g C. 64 g /mol D. 32 g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂综合处理含 NH4+废水和工业废气(主要含 N2、CO2、SO2、NO、CO,不考虑其他成分),设计的流程如下图,回答下列问题:
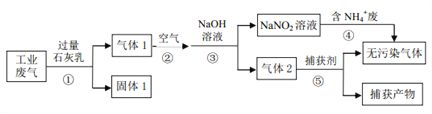
(1)固体 1的主要成分有______(填化学式)。
(2)反应①需控制反应的温度和气体的流速,其共同目的是______。
(3)反应④的离子方程式为______。
(4)已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O
在同温同压下,当反应②中NO与空气的体积比为______,经反应③,气体中NOx被完全吸收且仅生成 NaNO2。(设空气中氧气所占体积分数为 0.2)
(5)CuCl 的氨溶液常用作反应⑤的捕获剂。将(NH4)2SO3、NH4Cl与CuSO4 3种溶液相混可制得难溶物 CuCl。
① 理论上,(NH4)2SO3与CuSO4恰好反应时,n(SO32-):n(Cu2+)=______。
② 实际上, (NH4)2SO3的用量与 Cu2+的沉淀率关系如图所示,显然Cu2+沉淀率最高时,(NH4)2SO3的用量高于理论值其原因是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中所描述的物质一定是金属元素的是( )
A. 易得到电子的元素 B. 原子最外层只有一个电子的元素
C. 单质具有金属光泽的元素 D. 第三周期中,原子的最外层上只有2个电子的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com