
| A. | 晶体中有阳离子存在,就一定存在阴离子 | |
| B. | 离子键没有饱和性和方向性,但阴阳离子的配位数并不是任意的 | |
| C. | 电负性相差不大的两个原子,只要有未成对电子,就一定能形成共价键 | |
| D. | 如果分子间形成了氢键,物质的密度就会增大 |
分析 A、金属晶体是由金属阳离子和自由电子构成的;
B、配位数代表一个离子周围可容纳的最大的不同电性的离子数,虽然离子键没有饱和性,但是但相同电性的离子相切时会使能量增大,使晶体变得不稳定,以NaCl 和CsCl为例,这两个化合物阴离子相同,Cs+的半径大于Na-的半径,因此Cs+可以容纳更多的Cl-而不使他们相切,因此CsCl的配位数大于NaCl;
C、配位键就是一方提供电子对,双方共用;
D、如果分子间形成了氢键,导致体积膨胀,物质的密度减小.
解答 解:A、金属晶体是由金属阳离子和自由电子构成的,所以晶体中有阳离子不一定存在阴离子,故A错误;
B、配位数代表一个离子周围可容纳的最大的不同电性的离子数,虽然离子键没有饱和性,但是但相同电性的离子相切时会使能量增大,使晶体变得不稳定,以NaCl 和CsCl为例,这两个化合物阴离子相同,Cs+的半径大于Na-的半径,因此Cs+可以容纳更多的Cl-而不使他们相切,因此CsCl的配位数大于NaCl,所以离子晶体中配位数并不是任意的,故B正确;
C、配位键就是一方提供电子对,双方共用,所以不一定有未成对电子,故C错误;
D、如果分子间形成了氢键,导致体积膨胀,物质的密度减小,如冰的密度小于水的密度,故D错误;
故选B.
点评 本题考查晶体的构成微粒、配位键和氢键的相关知识,难度不大,注意对规律和基础知识的理解与运用.


科目:高中化学 来源: 题型:选择题
| A. | CH3COO-、SO42-、HCO3- | B. | SO42-、SO32-、CO32- | ||
| C. | SO32-、HCO3- | D. | CH3COO-、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将25 g CuSO4•5H2O溶于100 mL蒸馏水中,可以配成100 mL 1.0 mol/L CuSO4溶液 | |
| B. | 可以用重结晶法除去KNO3固体中混杂的NaCl,这是因为NaCl在水中的溶解度很大 | |
| C. | 利用实验器材(规格和数量不限):烧杯、玻璃棒、胶头滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的实验 | |
| D. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
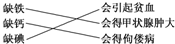
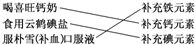

| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
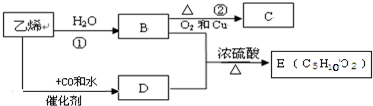
 CH3CH2COOCH2CH3+H2O.
CH3CH2COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3属于酸式盐,其水溶液显酸性 | |
| B. | CuCl2水解的实质是Cu2+与水电离出来的OH-结合生成了弱电解质Cu(OH)2 | |
| C. | 利用纯碱水解显碱性,可除去物品表面的油污 | |
| D. | 明矾【KAl(SO4)2•12H2O】用于净水的原因是明矾电离产生的Al3+水解产生Al(OH)3胶体,Al(OH)3胶体吸附水中悬浮的杂质. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
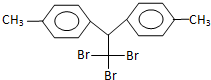 ,有关它的说法正确的是( )
,有关它的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子式为C16H14Br3 | ||
| C. | 分子中最多有24个原子共面 | D. | 1mol该物质能与6mol H2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com