
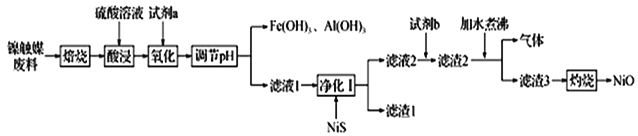
【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:
已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。
【答案】除去废料中的有机物;使部分金属单质转化为氧化物 漂液 节约成本,不影响后续操作 2Fe2++ClO-+2H+=2 Fe3++Cl-+H2O 5 Na2CO3 NiCO3+H2O![]() Ni(OH)2+CO2↑ 2 Ni(OH)2+OH--e-=NiOOH +H2O
Ni(OH)2+CO2↑ 2 Ni(OH)2+OH--e-=NiOOH +H2O
【解析】
铁触媒废料焙烧,可以将部分金属单质转化为金属氧化物以及使有机物燃烧而除去,焙烧后固体和硫酸反应生成硫酸盐;再将Fe2+氧化成Fe3+,氧化剂选择漂液(因为漂液价格低廉,且不影响后续实验)。然后调节pH使Fe3+、Al3+一起转化为氢氧化物沉淀而除去。滤液1中还有Zn2+、Cu2+以及Ni2+,加入NiS,可以除去Zn2+、Cu2+。滤液2中有镍离子,同样的道理,在沉淀Ni2+的时候,选择碳酸钠,它的价格也是比较低,加入碳酸钠后得到碳酸镍;碳酸镍加水煮沸会转化成Ni(OH)2,最后Ni(OH)2灼烧分解,就可以得到氧化镍。
(1)焙烧可以使部分金属单质变成金属氧化物,并且能够使有机物燃烧并除去。所以“焙烧”的目的为:除去废料中的有机物;使部分金属单质转化为氧化物;
(2)应选择氧化剂使亚铁离子氧化成铁离子,氧化剂包括了漂液和双氧水,但是双氧水的价格更贵,所以选择漂液;选择漂液的理由就是漂液成本更低,而且生成NaCl也不影响后续操作。
(3)漂液中含有NaClO,将Fe2+氧化成Fe3+,ClO-被还原成Cl-,反应的离子方程式为![]() ;
;
(4)Fe(OH)3和Al(OH)3类型相同,Fe(OH)3 的Ksp比Al(OH)3小,为了使它们完全沉淀,用Al(OH)3的Ksp进行计算, 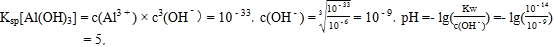 则pH至少为5;
则pH至少为5;
(5)需要选择沉淀Ni2+的沉淀剂,NaOH的价格更贵,所以选择Na2CO3,根据题意,加入Na2CO3时,生成的滤渣2为NiCO3,NiCO3加水煮沸转化成Ni(OH)2,加水煮沸的方程式为NiCO3+H2O![]() Ni(OH)2+CO2↑。
Ni(OH)2+CO2↑。
(6)镍氢电池放电时负极的是MH,在反应中MH变成了M,失去质量为H的质量,负极反应式为MH-e-+OH-=M+H2O,转移2mol,负极质量减少2g;充电时阳极发生氧化反应,化合价升高,Ni(OH)2变成NiOOH,电极反应式为:Ni(OH)2+OH--e-=NiOOH +H2O。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 不同核素的质量数必定不同
B. 互为同位素的原子,其质子数必定相等
C. 32S、33S具有不同的电子数
D. 核外电子数相同的微粒必定属于同一种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃油车尾气排放易形成NO和NO(常用NOx表示)污染。下列有关这两种氮氧化物气体的说法正确的是( )
A.NO为红棕色气体
B.NO易溶于水
C.NO2和水反应生成HNO3
D.NO可用排空气法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化过程中,氮元素化合价升高的是( )
A.雷雨条件下大气中的N2转变为HNO3
B.高温高压和Fe催化条件下工业合成NH3
C.蓝藻等原核生物将N2转变为铵盐
D.化肥NH4HCO3在使用中分解为NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中元素之间没有电子转移的是( )
A.HNO3和NH3反应生成NH4NO3
B.Fe在Cl2中点燃生成FeCl3
C.电解H2O制备H2和O2
D.H2和O2在燃料电池中转变H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镇痛药物J的合成方法如下:

已知:

(1)B的名称为_________________;F的结构简式为_______________。
(2)C中含氧官能团名称为_______________;②的反应类型为____________反应。
(3)③的化学方程式为_______________________________ 。
(4)有机物K分子组成比F少两个氢原子,符合下列要求的K的同分异构体有________种。
A.遇FeCl3显紫色 B.苯环上有三个取代基
(5)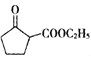 是一种重要的化工中间体。以环已醇(
是一种重要的化工中间体。以环已醇(![]() )和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出
)和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出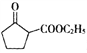 的合成路线____________________。(已知:RCH=CHR’
的合成路线____________________。(已知:RCH=CHR’![]() RCOOH+R’COOH,R、R'为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
RCOOH+R’COOH,R、R'为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com