
ŗĻ³É°±¹¤Ņµ”¢ĮņĖį¹¤ŅµµÄÉś²ś¹¤ŅÕĮ÷³Ģ“óÖĀĪŖ:

ŗĻ³ÉĖžŗĶ½Ó“„ŹŅÖŠµÄ·“Ó¦·Ö±šĪŖ:
N2(g)+3H2(g) 2NH3(g)””¦¤H<0;””2SO2(g)+O2(g)
2NH3(g)””¦¤H<0;””2SO2(g)+O2(g) 2SO3(g)””¦¤H<0
2SO3(g)””¦¤H<0
(1)Š“³öĮ÷³ĢÖŠÉč±øµÄĆū³Ę:B””””””””,X”””””””””£
(2)½ųČėŗĻ³ÉĖžŗĶ½Ó“„ŹŅÖŠµÄĘųĢ嶼ŅŖ½ųŠŠČČ“¦Ąķ,×īĄķĻėµÄČČ“¦Ąķ·½·ØŹĒ”””””””””£
(3)²ÉÓĆŃ»·²Ł×÷æÉĢįøßŌĮĻµÄĄūÓĆĀŹ,ĻĀĮŠÉś²śÖŠ,²ÉÓĆŃ»·²Ł×÷µÄŹĒ””””””””(ĢīŠņŗÅ)”£
¢ŁĮņĖį¹¤Ņµ””¢ŚŗĻ³É°±¹¤Ņµ””¢ŪĻõĖį¹¤Ņµ
(4)¹¤ŅµÉĻ³£ÓĆ98.3%µÄÅØĮņĖįĪüŹÕSO3¶ų²»ÓĆĻ”ĮņĖį»ņĖ®µÄŌŅņŹĒ”” ”£
(5)¹¤ŅµÉś²śÖŠ³£ÓĆ°±”ŖĖį·Ø½ųŠŠĪ²ĘųĶŃĮņ,ŅŌ“ļµ½Ļū³żĪŪČ¾”¢·ĻĪļĄūÓƵÄÄæµÄ”£ĮņĖį¹¤ŅµĪ²ĘųÖŠµÄSO2¾“¦ĄķæÉŅŌµĆµ½Ņ»ÖֻƷŹ,øĆ·ŹĮĻµÄ»ÆѧŹ½ŹĒ”” ”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
»ÆѧÓėÉś²ś”¢Éś»ī”¢Éē»įĆÜĒŠĻą¹Ų£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠ²»ÕżČ·µÄŹĒ £Ø £©
| A£®ÉńĘßÓīŗ½Ō±Ėł“©ŗ½Ģģ·žŹĒÓÉĪŅ¹ś×ŌŠŠŃŠÖʵĊĀŠĶ”°Į¬ŠųĻĖĪ¬ŌöČĶ”±ŗ½æÕ²ÄĮĻ×ö³É£¬ĘäÖ÷ŅŖ³É·ÖŹĒÓÉĢ¼»Æ¹č”¢ĢÕ“ÉŗĶĢ¼ĻĖĪ¬ø“ŗĻ¶ų³ÉµÄ£¬ĖüŹĒŅ»ÖÖŠĀŠĶĪŽ»ś·Ē½šŹō²ÄĮĻ |
| B£®Ź³Ę·°ü×°“ü”¢Ź³Īļ±£ĻŹÄ¤µČ²ÄĮĻµÄÖ÷ŅŖ³É·ŻŹĒ¾ŪĀČŅŅĻ© |
| C£®ČĖĢåČƻӊÄÜŹ¹ĻĖĪ¬ĖŲĖ®½ā³ÉĘĻĢŃĢĒµÄĆø£¬Ņņ“ĖĻĖĪ¬ĖŲ²»ÄÜ×÷ĪŖČĖĄąµÄÓŖŃųŹ³Īļ |
| D£®Õė¶Ō²”¶¾ŠŌĮ÷øŠµÄĄ©É¢Ēéæö£¬ŅŖ¼ÓĒæ»·¾³”¢øöČĖµČµÄĻū¶¾Ō¤·Ą£¬ĘäÖŠĻū¶¾¼Į³£Ń”ÓĆŗ¬ĀČĻū¶¾¼Į”¢¾Ę¾«”¢Ė«ŃõĖ®µČŹŹŅĖµÄĪļÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø12·Ö£©”¾»Æѧ”Ŗ”Ŗ»ÆѧÓė¼¼Źõ”æ
ŗĻ³É°±¹¤Ņµ¶Ō¹śĆń¾¼ĆŗĶÉē»į·¢Õ¹¾ßÓŠÖŲŅŖŅāŅ壬ĻĀĶ¼ŹĒ¹¤ŅµŗĻ³É°±µÄ¼ņŅŖĮ÷³ĢŹ¾ŅāĶ¼”£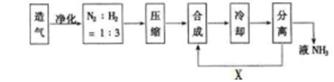
£Ø1£©ŗĻ³É°±µÄŌĮĻĘųĶłĶł»ģÓŠCO2µČŌÓÖŹ£¬ŌŚ½ųČėŗĻ³ÉĖžÖ®Ē°Šč¾»»Æ£¬ĘäŌŅņŹĒ_______ ”£
£Ø2£©¹¤ŅµÉĻŗĻ³É°±Ń”ŌńµÄŹŹŅĖĢõ¼žŹĒ£ŗŅŌĢśĪŖÖ÷µÄ“߻ƼĮ”¢_______”¢________”£
£Ø3£©ŃŲXĀ·Ļß½ųČėŗĻ³ÉĖžµÄĪļÖŹŹĒ_______£¬ÕāŃłÉč¼ĘµÄŅāŅåŹĒ________”£
£Ø4£©ÄæĒ°¹¤ŅµÖĘĻõĖįĖł²ÉÓƵÄÖ÷ŅŖ·½·ØŹĒ_______·Ø”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
øÖĢś¹¤ŅµŅŃ³ÉĪŖĪŅ¹śÖŲŅŖµÄÖ§Öł²śŅµ”£Ä³“óŠĶĢśæóø½½üÓŠĮ¶½¹Ćŗ”¢ŹÆ»ŅŹÆ”¢š¤ĶĮæóŗĶ·įø»µÄĖ®×ŹŌ“”£
(1)Ėę×ÅĢśæóµÄæŖ·¢£¬øƵŲ½ØĮ¢ĮĖČēĶ¼ĖłŹ¾Ī»ÖĆ¹ŲĻµµÄĮ¶½¹³§”¢øÖĢś³§”¢·¢µē³§ŗĶĖ®Äą³§”£ĒėŠ“³öĶ¼ÖŠB”¢DĖł“ś±ķµÄĮ½øö¹¤³§µÄĆū³Ę£ŗB.__________£»D.__________”£
(2)ĮņĢśæóĘäĶā¹ŪČē»Ę½š£¬¹ŹÓÖ±»³ĘĪŖ”°ÓŽČĖ½š”±”£ĻÖÓŠ»Ę½š”¢ÓŽČĖ½šĮ½ÖÖŠ”æéŹŌŃł£¬Ģį¹©µÄŅĒĘ÷Ö÷ŅŖÓŠ£ŗ
A£®ĶŠÅĢĢģĘ½ B£®¾Ę¾«ÅēµĘ
C£®ŹŌ¹Ü¼Š D£®ŪįŪöĒÆ
E£®ÉÕ± F£®ĮæĶ²
ĮķĶā£¬H2O”¢æÕĘųæÉČĪŅāŃ”ÓĆ£¬Ēė»Ų“šĪŹĢā£ŗ
ČōÓĆĪļĄķ·½·ØĄ“¼ų±šøĆ»Ę½š”¢ÓŽČĖ½šŹŌŃł£¬Ó¦Ń”ÓƵÄŅĒĘ÷ĪŖ__________(Ģī“śŗÅ)£»
¢ŚČōÓĆ»Æѧ·½·ØĄ“¼ų±šøĆ»Ę½š”¢ÓŽČĖ½šŹŌŃł£¬Ó¦Ń”ÓƵÄŅĒĘ÷ĪŖ__________(Ģī“śŗÅ)”£
(3)ĆŗĢæČ¼ÉÕÅŷŵÄŃĢ“ŃĘųÖŠŗ¬ÓŠNOxŗĶSO2”£ŗ¬ÓŠ¼īµÄ»ĘĮ×Čé×ĒŅŗÄܹ»Ķ¬Ź±Č„³żNOxŗĶSO2£¬ÕāŹĒÓÉĆĄ¹śæĘѧ¼ŅŃŠ·¢µÄ£¬ĆüĆūĪŖPhoSNOx·Ø”£ŌŚøĆ·½·ØµÄ×īŗó½×¶ĪNO2£ÓėHSO3£·“Ӧɜ³É(NH4)2SO4£¬ĘäĄė×Ó·½³ĢŹ½ĪŖ________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ĻĀ±ķĮŠ³öĮĖ3ÖÖČ¼ĆŗŃĢĘųĶŃĮņ·½·ØµÄŌĄķ”£
| ·½·Ø¢ń | ÓĆ°±Ė®½«SO2×Ŗ»ÆĪŖNH4HSO3£¬ŌŁŃõ»Æ³É(NH4)2SO4 |
| ·½·Ø¢ņ | ÓĆÉśĪļÖŹČČ½āĘų(Ö÷ŅŖ³É·ÖCO”¢CH4”¢H2)½«SO2ŌŚøßĪĀĻĀ»¹Ō³Éµ„ÖŹĮņ |
| ·½·Ø¢ó | ÓĆNa2SO3ČÜŅŗĪüŹÕSO2£¬ŌŁ¾µē½ā×Ŗ»ÆĪŖH2SO4 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
µē¶ĘĪŪÄąÖŠŗ¬ÓŠCr(OH)3”¢Al2O3”¢ZnO”¢CuO”¢NiOµČĪļÖŹ£¬¹¤ŅµÉĻĶعż”°ÖŠĪĀ±ŗÉÕ”ŖÄĘŃõ»Æ·Ø”±»ŲŹÕNa2Cr2O7µČĪļÖŹ”£
ŅŃÖŖ£ŗĖ®½žŗóČÜŅŗÖŠ“ęŌŚNa2CrO4”¢NaAlO2[Ņ²æɱķŹ¾ĪŖNaAl(OH)4]”¢Na2ZnO2µČĪļÖŹ”£
£Ø1£©Ė®½žŗó»ŲŹÕCu”¢NiŹ±µÄ²Ł×÷ŹĒ ”£Ė®½žŗóµÄČÜŅŗ³Ź ŠŌ£Ø”°Ėį”±”¢”°¼ī”±”¢”°ÖŠ”±£©
£Ø2£©Ķź³ÉŃõ»Æ±ŗÉÕ¹ż³ĢÖŠÉś³ÉNa2CrO4µÄ»Æѧ·½³ĢŹ½
Cr(OH)3 + Na2CO3 + O2 Na2CrO4 + CO2 + H2O
Na2CrO4 + CO2 + H2O
£Ø3£©ĀĖŌüIIµÄÖ÷ŅŖ³É·ÖÓŠZn(OH)2”¢ ”£
£Ø4£©ŅŃÖŖ£ŗ¢Ł³żČ„ĀĖŌüIIŗó£¬ČÜŅŗÖŠ“ęŌŚČēĻĀ·“Ó¦£ŗCrO42”Ŗ+ 2H+ Cr2O72”Ŗ+ H2O£»¢ŚNa2Cr2O7”¢Na2CrO4ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄČܽā¶ČČēĻĀ±ķ
Cr2O72”Ŗ+ H2O£»¢ŚNa2Cr2O7”¢Na2CrO4ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄČܽā¶ČČēĻĀ±ķ
| »ÆѧŹ½ | 20”ę | 60”ę | 100”ę |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
»ŌĶæóÖ÷ŅŖ³É·ÖCu2S£¬ČķĆĢæóÖ÷ŅŖ³É·ÖMnO2£¬ĖüĆĒ¶¼ŗ¬ÓŠÉŁĮæSiO2”¢Fe2O3µČŌÓÖŹ”£¹¤ŅµÉĻ×ŪŗĻĄūÓĆÕāĮ½ÖÖæóĪļÖʱøĮņĖįĆĢŗĶ¼īŹ½Ģ¼ĖįĶµÄÖ÷ŅŖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
ŅŃÖŖ£ŗ¢ŁMnO2Äܽ«½šŹōĮņ»ÆĪļÖŠµÄĮņŃõ»ÆĪŖµ„ÖŹĮņ£»
¢Ś[Cu(NH3)4]SO4³£ĪĀĪČ¶Ø£¬ŌŚČČĖ®ÖŠ»į·Ö½āÉś³ÉNH3£»
¢Ū²æ·Ö½šŹōŃōĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³Įµķ µÄpH·¶Ī§ČēĻĀ±ķĖłŹ¾£ØæŖŹ¼³ĮµķµÄpH°“½šŹōĄė×ÓÅضČĪŖ1.0 mol”¤L-1¼ĘĖć£©£ŗ
| | æŖŹ¼³ĮµķµÄpH | ³ĮµķĶźČ«µÄpH |
| Fe3£« | 1.1 | 3.2 |
| Mn2£« | 8.3 | 9.8 |
| Cu2£« | 4.4 | 6.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®øĆ·“Ó¦ÖŠµÄŃõ»Æ¼ĮÖ»ÓŠCu2O |
| B£®Cu¼ČŹĒŃõ»Æ²śĪļÓÖŹĒ»¹Ō²śĪļ |
| C£®Cu2SŌŚ·“Ó¦ÖŠ¼ČŹĒŃõ»Æ¼ĮÓÖŹĒ»¹Ō¼Į |
| D£®Ńõ»Æ²śĪļÓė»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ6£ŗ1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ČēĶ¼ĖłŹ¾ŹĒŅ»ÖÖ×ŪŗĻ“¦ĄķSO2·ĻĘųµÄ¹¤ŅÕĮ÷³Ģ£¬ČōĆæ²½¶¼ĶźČ«·“Ó¦”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ (””””)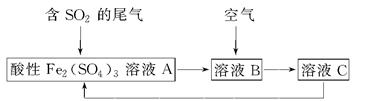
| A£®ČÜŅŗBÖŠ·¢ÉśµÄ·“Ó¦ĪŖ2SO2£«O2=2SO3 |
| B£®æÉÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗ¼ģŃéČÜŅŗCÖŠŹĒ·ńŗ¬ÓŠFe3£« |
| C£®ÓÉŅŌÉĻĮ÷³ĢæÉĶĘÖŖŃõ»ÆŠŌ£ŗFe3£«>O2>SO42”Ŗ |
| D£®“Ė¹¤ŅÕµÄÓŵćÖ®Ņ»ŹĒĪļÖŹÄÜŃ»·ĄūÓĆ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com