
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子化合物中一定存在离子键 |
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| C. | 将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 | |
| D. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
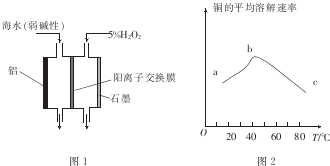
| 实验 体积/mL 液体 | A | B | C | D |
| 0.4mol.L-1Fe2(SO4)3溶液 | 0 | 1.8 | 2.0 | V1 |
| 30%H2O2溶液 | 20.0 | 20.0 | 20.0 | 20.0 |
| HO2 | V2 | V3 | 15.0 | 13.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的水与重水含有的电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的原子数 | |
| D. | 常温下等物质的量的铝分别与足量氯气、浓硝酸反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
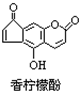
| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1mol最多可消耗7mol H2 | |
| C. | 它与溴水发生反应,1mol最多消耗3mol Br2 | |
| D. | 它与NaOH溶液反应,1mol最多消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑧⑨⑩ | B. | ②④⑥⑦ | C. | ②⑤⑦⑧⑩ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>S | ||
| C. | 热稳定性Na2CO3>NaHCO3 | D. | 碱性:NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若原子半径X>Y,则气态氢化物稳定性:HmX<HnY | |
| B. | X、Y一定不是同周期元素 | |
| C. | 由mXa-与nYb-得m+a=n-b | |
| D. | Xa-的还原性一定强于Yb- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com