

分析 由流程可知,设备①中用苯萃取废液中的苯酚、再进行分液分离,设备②加入氢氧化钠溶液,可得到苯酚钠,分液得到苯进行循环利用,在设备③中通入二氧化碳可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,设备④中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀,过滤分离,氢氧化钠溶液循环利用,碳酸钙在设备⑤中加热分解得到CaO与CO2,二者也进行循环利用.
(6)苯酚分子式为C6H6O,苯酚的同分异构体中核磁共振氢谱只有一个峰,说明只有一种氢原子,即结构对称,分子中无碳碳双键,说明含两个碳碳三键,氧在中间位置,据此书写.
解答 解:由流程可知,设备①中用苯萃取废液中的苯酚、再进行分液分离,设备②加入氢氧化钠溶液,可得到苯酚钠,分液得到苯进行循环利用,在设备③中通入二氧化碳可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,设备④中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀,过滤分离,氢氧化钠溶液循环利用,碳酸钙在设备⑤中加热分解得到CaO与CO2,二者也进行循环利用.
(1)工业废水与苯进入设备①得到苯酚、苯的溶液,并分离出水,说明在设备①中进行的是萃取与分液,实验室这一步操作所用的仪器是分液漏斗,
故答案为:萃取与分液;分液漏斗;
(2)由上述分析可知,由设备②进入设备③的物质A是C6H5ONa,
故答案为:C6H5ONa;
(3)二氧化碳和苯酚钠反应生成苯酚与碳酸氢钠,反应的方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
(4)物质B为NaHCO3,设备④中有关反应方程式为:CaO+H2O=Ca(OH)2,Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O,
故答案为:NaOH;
(5)由上述分析可知,苯、氧化钙、CO2、和NaOH均可以循环使用,
故答案为:CO2;
(6)苯酚分子式为C6H6O,苯酚的同分异构体中核磁共振氢谱只有一个峰,说明只有一种氢原子,即结构对称,分子中无碳碳双键,说明含两个碳碳三键,氧在中间位置,结构简式为:CH3-C≡C-O-C≡C-CH3,
故答案为:CH3-C≡C-O-C≡C-CH3.
点评 本题考查物质分离提纯综合应用,关键理解工业废水提取苯酚的工艺流程,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯 (  )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 取卤代烃,加入氢氧化钠的乙醇溶液加热一段时间后冷却,再加入稀硝酸酸化的硝酸银溶液,一定会产生沉淀,并根据沉淀颜色判断卤代烃中卤原子的种类 | |
| D. | 通常条件下,1mol的  分别与H2 和浓溴水完全反应时,消耗的H2和 分别与H2 和浓溴水完全反应时,消耗的H2和Br2的物质的量分别是 4mol、3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室制取乙烯的装置如下图所示,请回答:
实验室制取乙烯的装置如下图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

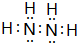 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素基态原子中共有13个电子 | B. | 该元素原子核外有3个电子层 | ||
| C. | 该元素原子最外层共有5个电子 | D. | 该元素原子L能层共有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
| A. | 小于0.8 | B. | 大于1.2 | C. | 在0.8与1.2之间 | D. | 在0.8与1.5之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com