
【题目】镍具有良好的导磁性和可塑性,主要用于制作合金及催化剂。请回答下列问题
(1)基态镍原子的价电子排布图为____,同周期元素中基态原子与镍具有相同未成对电子的还有____种。
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为___三种组成元素按电负性由大到小的顺序为____。
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为____,写出与SO42-互为等电子体的一种分子和一种离子的化学式____,____;[Ni(
NH3)4]SO4中H-N-H键之间的夹角___(填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角。
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的____体空隙中,其空隙的填充率为____。
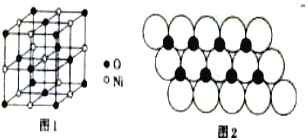
(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为___g。(用a、NA表示)
【答案】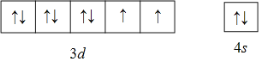 3 1:1 O>C>Ni sp3 CCl4 ClO4- > 正八面 100%
3 1:1 O>C>Ni sp3 CCl4 ClO4- > 正八面 100% ![]()
【解析】
(1)Ni是28号元素,其价电子为3d、4s能级上的电子;Ni原子核外有2个未成对电子,同周期元素中基态原子与镍具有相同未成对电子的还有Ti、Ge、Se元素;
(2)CO中含有1个σ键、1个π键,每个CO分子和Ni原子形成一个σ键,所以一个Ni(CO)4中含有σ键8个、π键8个;元素的非金属性越强,其电负性越大;
(3)[Ni(NH3)4]SO4中N原子的价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化类型,与SO42-互为等电子体的一种分子和一种离子中原子个数为5、价电子数为32;[Ni(NH3)4]SO4中N原子、NH3分子中N原子都采用sp3杂化,但是前者不存在孤电子对、后者含有1个孤电子对,成键电子对之间的排斥力小于成键电子对和孤电子对之间的排斥力;
(4)氧原子位于面心和顶点,Ni位于棱心和体心,由图可知体心Ni原子的配位数为6,故Ni位于6个面心O形成正八面体中心;其空隙的填充率为100%;
(5)平面NiO基本结构单元为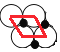 ,每个结构单元含有1个“NiO“,每个氧化镍所占的面积=(2a m)×(2a m×sin60°)=2
,每个结构单元含有1个“NiO“,每个氧化镍所占的面积=(2a m)×(2a m×sin60°)=2![]() a2m2,计算1个“NiO“的质量,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量。
a2m2,计算1个“NiO“的质量,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量。
(1)Ni是28号元素,其价电子为3d、4s能级上的电子;Ni原子核外有2个未成对电子,其价电子排布图为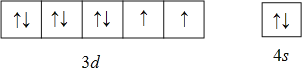 ;同周期元素中基态原子与镍具有相同未成对电子的还有Ti、Ge、Se元素,所以有3种元素,故答案为:
;同周期元素中基态原子与镍具有相同未成对电子的还有Ti、Ge、Se元素,所以有3种元素,故答案为: ;3;
;3;
(2)CO中含有1个σ键、1个π键,每个CO分子和Ni原子形成一个σ键,所以一个Ni(CO)4中含有σ键8个、π键8个,所以四羰基合镍中σ键和π键数目之比=8:8=1:1;元素的非金属性越强,其电负性越大,非金属性O>C>Ni,所以电负性O>C>Ni,故答案为:1:1;O>C>Ni;
(3)[Ni(NH3)4]SO4中N原子的价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化类型为sp3,与SO42-互为等电子体的一种分子如CCl4,一种离子如ClO4-;[Ni(NH3)4]SO4中N原子、NH3分子中N原子都采用sp3杂化,但是前者不存在孤电子对、后者含有1个孤电子对,成键电子对之间的排斥力小于成键电子对和孤电子对之间的排斥力,所以;[Ni(NH3)4]SO4中H-N-H键之间的夹角>NH3分子中H-N-H键之间的夹角,故答案为:sp3;CCl4;ClO4-;
(4)氧原子位于面心和顶点,Ni位于棱心和体心,由图可知体心Ni原子的配位数为6,故Ni位于6个面心O形成正八面体中心,其空隙的填充率为100%,故答案为:正八面;100%;
(5)平面NiO基本结构单元为 ,每个结构单元含有1个“NiO",每个氧化镍所占的面积=(2am)×(2am×sin60°)=2
,每个结构单元含有1个“NiO",每个氧化镍所占的面积=(2am)×(2am×sin60°)=2![]() a2m2,则每平方米含有的氧化镍个数=
a2m2,则每平方米含有的氧化镍个数=![]() ,每个氧化镍的质量=
,每个氧化镍的质量=![]() g,所以每平方米含有的氧化镍质量=
g,所以每平方米含有的氧化镍质量=![]() g×
g×![]() =
=![]() g,故答案为:
g,故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于反应mA(s) + nB(g) ![]() eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是

A. 化学方程式中n<e +f
B. 达到平衡后,若升温,v正减小,v逆增大
C. 达到平衡后,增加B的量,B的转化率增大
D. 若B为有色物质,达到平衡后缩小容器体积,重新达平衡后与原平衡比较气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同位素的是___(填写序号,下同),互为同素异形体的是__,互为同分异构体的是___,是同一种物质的是____,属于同系物的是__。
①H-O-C≡N与H-N=C=O
②CuSO4与CuSO45H2O
③H2O与D2O
④H、D与T
⑤O2与O3
⑥CH3CH2CH3与CH3CH2CH2CH3
⑦CH3CH2CHO与![]()
⑧CH3-CH2-CH=CH2与CH3-CH=CH-CH3
⑨ 与
与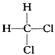
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为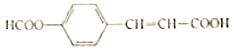 有关该化合物的叙述不正确的是( )
有关该化合物的叙述不正确的是( )
A.所有碳原子可能共平面
B.可以发生水解、加成和酯化反应
C.1mol该物质最多消耗2molNaOH
D.苯环上的二溴代物同分异构体数目为4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O = SO42+4H++2Fe2+,Cr2O72+6Fe2++14H+ = 2Cr3++6Fe3++7H2O。下列说法正确的是( )
A.还原性:Cr3+>Fe2+>SO2B.氧化性:Cr2O72>Fe3+>SO2
C.Cr2O72不能将SO2氧化D.两个反应中Fe2(SO4)3均作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秸秆(含多糖类物质)的综合利用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为________。
(3)D中的官能团名称为________,D生成E的反应类型为________。
(4)F的化学名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(III)酸钾K3[Fe
(C
2O4)3]3H2O(其相对分子质量为491),为绿色晶体,易溶于水,难溶于酒精。110℃下可完全失去结晶水,230℃时分解。它还具有光敏性,光照下即发生分解,是制备活性铁催化剂的原料。某化学小组制备该晶体,并测定其中铁的含量,进行如下实验:
Ⅰ.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O42H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O42H2O晶体的化学方程式___。检验FeC2O42H2O晶体是否洗涤干净的方法是___。
(2)步骤②中检验Fe2+是否完全转化的操作为___。
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是___。
Ⅱ.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化,MnO4-被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+。
步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯____,___,___。
(5)写出步骤三中发生反应的离子方程式____。
(6)实验测得该晶体中铁的质量分数为____(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成多种药物的重要中间体,一种合成路线如下:
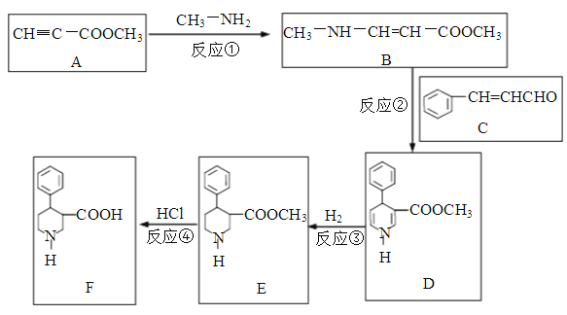
回答下列问题:
(1)写出反应类型。反应①是__________反应,反应④是__________反应。
(2)化合物A中有________种官能团,写出含氧官能团的结构式_____________。
(3)化合物C的俗名是肉桂醛,其分子式是____________。写出肉桂醛跟新制Cu(OH)2在煮沸条件下发生反应的化学方程式______________________。
(4)由肉桂醛( ![]() )和乙酸制备
)和乙酸制备![]() 的合成路线如下:
的合成路线如下:
![]()
请将该合成路线补充完整(无机试剂任选)。________________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞香素具有消炎杀菌作用,结构如图所示,下列叙述正确的是
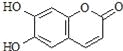
A.与稀H2SO4混合加热不反应
B.不能使酸性高锰酸钾溶液褪色
C.1mol 瑞香素最多能与3mol Br2发生反应
D.1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com