
【题目】下列关于“摩尔”的说法正确的是( )
A.摩尔是一个物理量
B.摩尔是表示物质的量
C.摩尔是物质的量的单位
D.摩尔是表示物质数量的单位
科目:高中化学 来源: 题型:
【题目】下列有关说法中,正确的是
A.与铝反应产生H2的溶液一定呈酸性
B.钠与硫酸铜溶液反应后置换出红色的铜
C.次氯酸具有强氧化性,可用于自来水的杀菌消毒
D.二氧化硅不与任何酸反应,可用石英制造耐酸容器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氧(NOCl)是有机合成中的重要试剂,工业上可由NO与Cl2反应制得,回答下列问题:
(1)NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_______
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰气,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g) ΔH1 K1;
NaNO3(s)+NOCl(g) ΔH1 K1;
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH2 K2;
2NaNO3(s)+2NO(g)+Cl2(g) ΔH2 K2;
2NO(g)+Cl2(g)![]() 2NOCl(g) ΔH3 K3;
2NOCl(g) ΔH3 K3;
则ΔH3=_____(用ΔH1和ΔH2表示),K3=______(用K1和K2表示)
(3)25℃时,向2L带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2(g)=2NOCl(g)ΔH
①测得其压强(p)随时间(t)的变化如图I曲线a所示(反应达到平衡时的温度与起始温度相同),则ΔH___0(填“>”或“<”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图I曲线b所示,则改变的条件是______。
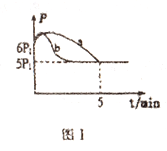
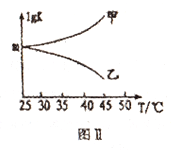
②图Ⅱ是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是______ (填“甲”或“乙”);m值为_______
(4)NO可用间接电化学法除去,其原理如图3所示
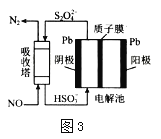
①阴极的电极反应式为_________
②吸收塔内发生反应的离子方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁是常见的两种金属,它们的单质及化合物在生活生产中处处可见。
(1)过量的铁和稀硝酸发生反应,产物是Fe(NO3)2和NO,写出该反应的化学方程式_________________________________________________。
(2)实验室配制FeSO4溶液时,如果没有隔绝空气,FeSO4会被氧化为___________(填化学式)。在该溶液中加入___________试剂,看到_____________________现象,证明溶液变质。
(3)已知:Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。

由图可知c点的沉淀是___________(填化学式),已知a-b时存在的沉淀是Al(OH)3和BaSO4,a点时,n(BaSO4)_____ n(Al(OH)3)(填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br-废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。
已知:①2NaOH+Cl2==NaCl+NaClO+H2O
②Br2极易溶于四氯化碳和正十二烷
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
在水中溶解性 | 微溶 | 难溶 | 难溶 |

下列说法不正确的是
A. 甲装置中Br-发生的反应为:2Br-+Cl2===Br2+2Cl-
B. 甲装置中NaOH溶液每吸收1个Cl2,转移1个e-
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量NaCl、Na2SO4、Na2CO3、泥沙(SiO2)等杂质的NaNO3固体,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
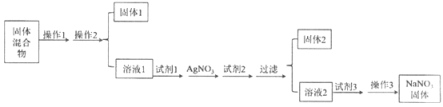
(1)操作1、操作3的名称分别是_________、_________。
(2)试剂1和试剂2分别是_________、_________。固体2中除了含有AgCl,还有_________(答全)。
(3)试剂3加入后发生的离子反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
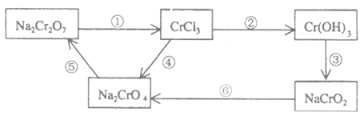
(1)配平并回答问题,用单线桥标出2个反应的电子转移的方向和数目。
反应①为:__Na2Cr2O7+__HCl→__NaCl+__CrCl3+__Cl2↑+____,氧化剂_______,氧化产物__________。
反应⑥为:__ClO3-+__CrO2-+____→__Cl-+__CrO42-+__H2O,还原剂________,还原产物__________。
(2)在上述有编号的步骤中,除了①⑥外,需用氧化剂的步骤是(填编号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的分类中依次按照强电解质、弱电解质和非电解质排列全部正确的组合是()
A.NaCl HF Cl2B.NaHCO3 NH3·H2O CCl4
C.Ba(OH)2 HCl CuD.AgCl H2SO4 C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g)![]() CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。
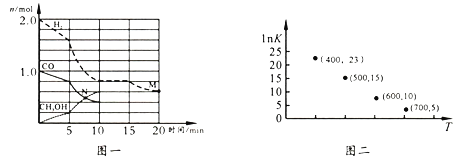
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com