
| A. | 草酸稀溶液加水稀释,溶液中所有离子浓度均减小 | |
| B. | NaHC2O4溶液中有:2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| C. | pH=3的草酸与pH=12的NaOH溶液混合至中性时,溶液中有:c(Na+)=c(HC2O4-)+2c(C2O42-) | |
| D. | 等浓度的草酸和碳酸相比,溶液中由水电离出来的c(H+)前者更多 |
分析 A.稀释过程中水的离子积不变,而氢离子浓度减小,则氢氧根离子浓度增大;
B.根据NaHC2O4溶液中的物料守恒判断;
C.溶液为中性,则氢离子与氢氧根离子浓度相等,结合电荷守恒可知c(Na+)=c(HC2O4-)+2c(C2O42-);
D.酸性越强,等浓度时电离出的氢离子浓度越大,对水的电离的抑制程度越大.
解答 解:A.草酸稀溶液加水稀释,溶液中氢离子浓度减小,而水的离子积不变,所以溶液中的氢氧根离子浓度增大,故A错误;
B.NaHC2O4溶液中,根据物料守恒可得:c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故B错误;
C.pH=3的草酸与pH=12的NaOH溶液混合至中性时,则:c(H+)=c(OH-),结合电荷守恒可得:c(Na+)=c(HC2O4-)+2c(C2O42-),故C正确;
D.酸抑制了水的电离,氢离子浓度越大,水的电离程度越小,等浓度的草酸和碳酸相比,由于草酸的酸性大于碳酸,则溶液中由水电离出来的c(H+)草酸小于醋酸,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及水的电离及其影响、弱电解质的稀释、离子浓度大小比较等知识,注意掌握电荷守恒、物料守恒及盐的水解原理在比较离子浓度大小中的应用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

 .
. 、、
、、 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
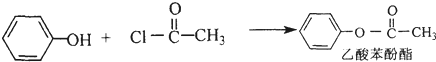 +HCl
+HCl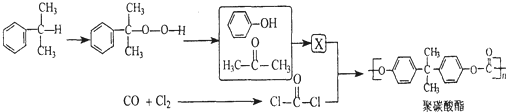
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
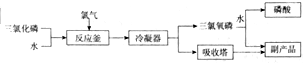

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 有些活泼金属如铝可用作热还原法的还原剂 | |
| D. | 金属在地壳中含量很高,回收废旧金属浪费人力物力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
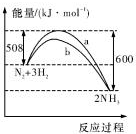
| A. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92kJ.mol-1 | |
| B. | 生成物的能量之和比反应物的能量之和高 92 kJ | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增加正反应速率,减小逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O的质子数相同 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同素异形体 | |
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相差2 | |
| D. | ${\;}_{8}^{17}$O原子核内中子数与核外电子数之差为1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com