
【题目】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3
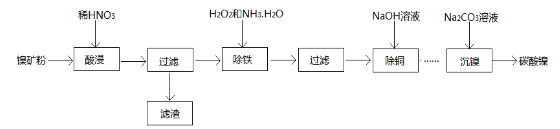
已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________,滤渣的主要成分为________________________;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________;反应完全后,除去多余H2O2的简便方法是______________________;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________(用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________;
【答案】 3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O SiO2 NiCO3中可能混有Ni2(CO3)3 煮沸(或加热) CO32-+H2O![]() HCO3-+OH-,Ni2++2OH-=Ni(OH)2或合并书写 静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全
HCO3-+OH-,Ni2++2OH-=Ni(OH)2或合并书写 静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全
【解析】试题分析:(1)CuS与稀HNO3反应生成淡黄色固体,说明生成S单质;NiS、FeS、CuS和SiO2只有SiO2不与硝酸反应;(2)强氧化剂能把Ni2+氧化为Ni3+;H2O2加热易分解;(3)碳酸钠水解溶液显碱性,Ni2+与OH-反应生成Ni(OH)2沉淀;继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。
解析:(1)CuS与稀HNO3反应生成淡黄色固体,说明生成S单质,反应的离子方程式为3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O;NiS、FeS、CuS和SiO2只有SiO2不与硝酸反应,所以滤渣的主要成分为SiO2;(2)强氧化剂能把Ni2+氧化为Ni3+,若用过强的氧化剂,其可能的后果是NiCO3中可能混有Ni2(CO3)3杂质;H2O2加热易分解,除去多余H2O2的简便方法是煮沸;(3)碳酸钠水解溶液出碱性CO32-+H2O![]() HCO3-+OH-,Ni2+与OH-反应生成Ni(OH)2沉淀Ni2++2OH-=Ni(OH)2;检验碳酸镍沉淀完全的方法是静置、向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。
HCO3-+OH-,Ni2+与OH-反应生成Ni(OH)2沉淀Ni2++2OH-=Ni(OH)2;检验碳酸镍沉淀完全的方法是静置、向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )

A. Ⅱ表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
I、铁矿石中含氧量的测定
①按下图组装仪器,检查装置的气密性;
②将 10.0g 铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地通入 H2,______,点燃 A 处酒精灯;
④……
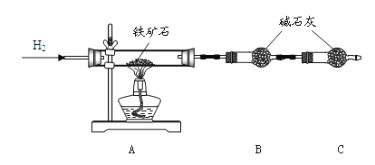
(1)装置 C 的作用为_______________________________________ 。
(2)将步骤③的操作补充完整:_________。
(3)实验结束后的操作包括: a.冷却至室温 b.熄灭 A 处的酒精灯 c.停止通 H2。正确的顺序为:_________(填序号)。
(4)实验测得反应后装置 B增重 2.7g,据此可以测出铁矿石中氧的含量。有同学认为,不测定 B 装置的净增质量,通过测定_________,也能达到实验目的。
II、铁矿石中含铁量的测定
将上述实验结束后硬质玻璃管中的固体全部取出,用足量稀硫酸浸取后过滤。向滤液中通入足量Cl2 并加热煮沸得溶液 M,冷却后将溶液 M 稀释至 250mL。取 20.00mL M 的稀溶液,用 0.5000mol·L-1的标准 KI 溶液与其反应,消耗 KI 溶液 20.00 mL。
(5)向滤液中通入足量 Cl2 的目的是将其中的 Fe2+氧化成 Fe3+。将通入 Cl2 后的溶液加热煮沸的目的则是_________。 若省去该操作,则所测铁的百分含量将_________。(填“偏大”, “偏小”或“无影响”)。
(6)标准 KI 溶液与 M 稀溶液发生反应的离子方程式为:_________。
III、化学式的确定
(7)结合 I、 II 的实验数据计算该铁矿石中铁的氧化物的化学式为_________。 (请化成最简单的整数比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示内容填空: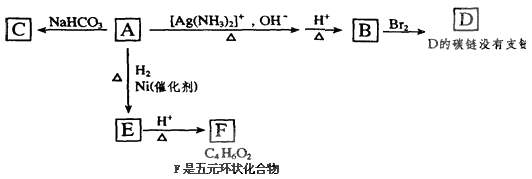
(1)化合物A中含氧官能团的名称为、 .
(2)与A具有相同官能团的A的同分异构体的结构简式是 .
(3)B生成D的反应方程式为 .
(4)丁烯二酸(HOOCCH=CHCOOH)可用于制造不饱和聚酯树脂,也可作食品的酸性调味剂.请设计以ClCH2CH=CHCH2Cl为原料,合成丁烯二酸的合成路线流程图.
例: 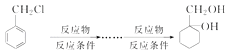
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2A(g)+B(g)3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
A.v(A)=0.7molL﹣1min﹣1
B.v (B)=0.3molL﹣1min﹣1
C.v (C)=0.9molL﹣1min﹣1
D.v (D)=0.8molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用含NH4+废水处理工业废气(其化学成分为CO2、SO2、NO,不考虑其他成分)的工艺流程如下:

(1)固体1的主要成分为Ca(OH)2、___________。
(2)气体2无毒性,写出处理含NH4+废水时所发生反应的离子方程式:_________________________。
(3)查阅资料可知:向2mol气体1中通入不同量的O2,并将所得混合气体通入NaOH溶液中,有关含氮组分的物质的量变化如图所示。

上述工艺流程中气体1与O2的体积比(相同条件)应控制为_____________________________。
(4)为测定上述流程中所得NaNO2溶液的物质的量浓度,准确量取10.00mLNaNO2溶液样品与24.00mL0.05mol/L过量的酸性KMnO4溶液充分反应,反应后所得溶液用0.1mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去,消耗(NH4)2Fe(SO4)2溶液10.00mL。
通过计算确定NaNO2溶液的物质的量浓度(写出计算过程)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生下图所示一系列变化,则下列说法错误的是
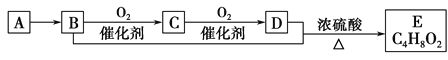
A. A分子中所有原子均在同一平面内
B. C4H8O2含酯基的同分异构体有4种
C. C的水溶液又称福尔马林,具有杀菌、防腐性能
D. 等物质的量的B、D与足量钠反应生成气体的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见化学物质的应用不正确的是( )
A.干冰能用作冷冻剂
B.明矾可用作净水剂
C.味精可用作食品调味剂
D.苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH3CH3+Cl2 ![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
B.CH2═CH2+HBr→CH3CH2Br
C.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH ![]() H3COOCH2CH3+H2O
H3COOCH2CH3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com