
【题目】在元素周期表中最容易找到半导体材料的合理位置是
A.金属元素和非金属元素交界处B.过渡元素区
C.周期表的右上角D.周期表的左下角
科目:高中化学 来源: 题型:
【题目】第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。

(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于镁、铝的叙述中不正确的是( )
A、铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气
B、镁铝合金的强度和硬度都比纯铝和纯镁大
C、在高温下,可以用铝制的容器装运浓硫酸或浓硝酸
D、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而失去光泽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp[Mg(OH)2]=10-12,Ksp(MgF2)=10-10。下列说法正确的是( )
A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
B. 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
C. 25℃时,Mg(OH)2固体在20mL 0.01 molL-1氨水中的Ksp比在20mL 0.01 molL-1NH4Cl溶液中的Ksp小
D. 25℃时,欲用1L NaF溶液将0.05mol Mg(OH)2完全转化为MgF2,则c(NaF)≥1.1 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,不正确的是
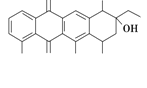
A. 阿克拉酮的分子式为C22H22O8
B. 分子中含有3个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质最多可与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
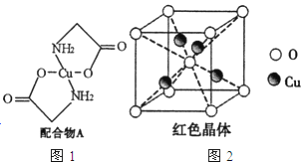
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁[MgCO3·Mg(OH)2·3H2O]是重要的化工原料。用橄榄石制取碱式碳酸镁的一种工艺流程如图所示。

已知:阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阴离子 | 开始沉淀时的pH | 怡好完全沉淀时的pH |
Fe3+ | 2.7 | 3.7 |
Mg2+ | 9.7 | 11 |
(1)将Mg9FeSi5O20改写成氧化物的形式:___________________。
(2)将橄榄石粉碎的目的是___________________________。
(3)“调节pH”时,应调节的pH范围是________________________。
(4)加入H2O2后发生反应的离子方程式为_____________________________________。
(5)Ksp[Mg(OH)2]=_______。写出生成碱式碳酸镁的离子方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com