
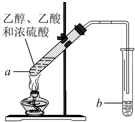
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.分析 (1)乙醇与乙酸反应生成乙酸乙酯,乙醇中含-OH、乙酸中含-COOH、乙酸乙酯中含-COOC-;
(2)不加碎瓷片,加热时液体可能剧烈沸腾,液滴飞溅;
(3)试管a中发生酯化反应生成乙酸乙酯和水;
(4)试管b中为碳酸钠溶液,可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;
(5)试管b内的液体分成两层,乙酸乙酯的密度小在上层,利用分液法分离.
解答 解:(1)乙醇与乙酸反应生成乙酸乙酯,乙醇中含-OH、乙酸中含-COOH、乙酸乙酯中含-COOC-,则官能团的名称分别为羟基、羧基、酯基,
故答案为:羟基、羧基、酯基;
(2)试管a中加入几块碎瓷片的目的是防止暴沸,故答案为:防止暴沸;
(3)试管a中发生反应的化学方程式为CH3COOH+C2H5OH$?_{加热}^{浓硫酸}$CH3COOC2H5+H2O,属于酯化反应(取代反应),
故答案为:CH3COOH+C2H5OH$?_{加热}^{浓硫酸}$CH3COOC2H5+H2O;酯化反应(取代反应);
(4)反应开始前,试管b中盛放的溶液是饱和碳酸钠溶液,其作用为中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度,有利于分层,
故答案为:饱和碳酸钠溶液;中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度,有利于分层;
(5)试管b内的液体分成两层,乙酸乙酯的密度小在上层,分离10mL该液体混合物选择分液法,需要用到的主要玻璃仪器是分液漏斗、烧杯,
故答案为:上;分液漏斗、烧杯.
点评 本题考查有机物的制备实验,为高频考点,侧重于学生的分析与实验能力的考查,把握有机物的结构与性质、有机制备原理是解答该题的关键,注意混合物分离提纯的应用,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈现+2价 | B. | 氢氧化物呈强碱性 | ||
| C. | 单质与冷水不反应 | D. | 碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相等的SO2和CO2 | B. | 密度不同、质量相等的CO和C2H4 | ||
| C. | 等温等体积的NO和HCl | D. | 等压等体积的N2和CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属钛冶炼过程中得到MgCl2,将熔融态MgCl2电解可得到金属镁和Cl2,氯气可制得漂白液、“84消毒液”等生活用品,试回答下列问题:
金属钛冶炼过程中得到MgCl2,将熔融态MgCl2电解可得到金属镁和Cl2,氯气可制得漂白液、“84消毒液”等生活用品,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com