
【题目】下表各组物质之间通过一步反应不可以实现如图所示的转化
关系是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
C | Fe2O3 | FeCl3 | Fe(OH)3 | ④加入盐酸 |
D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
Ⅰ、金属Ca的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca+H2![]() CaH2(固体)
CaH2(固体)
Ⅱ、固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑;②CaH2要密封保存。
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).

回答下列问题:
(1)写出Ca常温遇水发生反应的化学方程式: 。
(2)B、D中所盛试剂相同,该试剂为 (填名称);D中该试剂的作用是 。
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: 。
【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2 样品,按图所示连接仪器(固定装置略)。

步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL。
(4)若该实验条件下的气体摩尔体积为Vm L/mol,当V= mL时(用m、Vm表示),表明制得的CaH2样品是纯净的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4 ![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据________________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理__________________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理________________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
(1)A的组成元素为_____________(用元素符号表示),化学式为__________。
(2)溶液C可溶解铜片,例举该反应的一个实际应用________________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________。写出该反应的离子方程式______________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。下列有关叙述正确的是( )
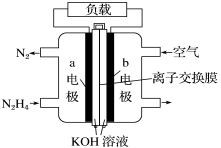
A.该燃料电池放电时,正极发生氧化反应,pH变大
B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活处处有化学。下列说法正确的是 ( )
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是_________,属于非电解质的是______________。
(2)过量②的水溶液与⑦反应的离子方程式______________________。
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①请用双线桥标出电子转移的方向和数目;
②被氧化与未被氧化的H2SO4的物质的量之比为___________,当电子转移0.1mol时,消耗还原剂的质量为_______________。
(4)如图1表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是___________,这样操作所配制的溶液比要求的浓度要___________ (填“偏高”、“偏低”、“不影响”)。配制应称取___________gNaOH。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 molA气体和2 molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) ![]() 2C(g),若经2s(秒)后测得C的浓度为0.6 mol.L-1现有下列几种说法:
2C(g),若经2s(秒)后测得C的浓度为0.6 mol.L-1现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol.L-1.S-1
②用物质B表示的反应的平均速率为0.6mol.L-1.S-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol.L-1
其中正确的是 ( )
A.①③ B.①④ C、②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
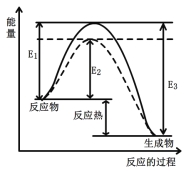

图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式 (热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 _______(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 _____(填“增大”、“不变”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com