
�ճ�����ˮ��NO3һ�ĺ�����ˮ�������������Ҫ��֮һ���ﵽһ��Ũ��ʱ������ཡ������Σ����Ϊ�˽�������ˮ��NO3һ��Ũ�ȣ�ij��ȤС��������·�����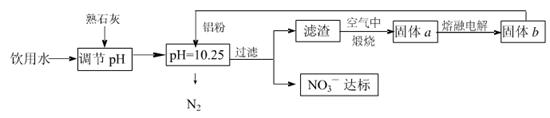
��ش��������⣺
��1���÷����ڵ���pHʱ����pH������С������� �������ʽ��͡�
��2����֪���˺�õ�����Һ�м���������Ԫ�ء�������Һ�����ۺ�NO3һ��Ӧ�����ӷ���ʽΪ ��
�������ڿ��������չ������漰����ط�Ӧ����ʽΪ
��3����H2����ԭ��Ҳ�ɽ�������ˮ��NO3����Ũ�ȣ���֪��Ӧ�еĻ�ԭ���������������ɲ������ѭ���������ԭ�������ӷ���ʽΪ ��
��4������ˮ�е�NO3�� ��Ҫ������NH4������֪�����������£�NH4�� ����������Ӧ��������NO3�� ��������Ӧ�������仯ʾ��ͼ���£�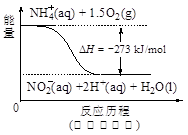

��д��1 mol NH4�� (aq)ȫ��������NO3�� (aq)���Ȼ�ѧ����ʽ�� ��
��5������a���ڵ��ʱ������ӦʽΪ
��1��������Al��(2��)
��2����10Al+6NO3��+18H2O��10Al(OH)3��+3N2��+6OH��(2��)
��4Al+ 3O2 2 Al2 O3 2Al(OH)3
2 Al2 O3 2Al(OH)3 Al2 O3+3 H2O����2�֣�
Al2 O3+3 H2O����2�֣�
��3��5H2+2NO3��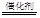 N2��+4H2O+2OH�� (2��)
N2��+4H2O+2OH�� (2��)
����5H2+2NO3����2H��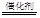 N2��+6H2O��
N2��+6H2O��
��4��NH4�� (aq)��2O2(g)��2H��(aq)��NO3�� (aq)��H2O(l) ��H����346 kJ��mol��1(2��)
��5��Al3++3e-= Al��2�֣�
���������������1���������ܺ�����ܷ�Ӧ���÷����ڵ���pHʱ����pH������С�������������Al�� �������ʽ��͡���2������������������ӷ���������ԭ��Ӧ���ɹ��壬�����Ϊ���������������ᱻ��ԭΪ������������Һ�����ۺ�NO3����Ӧ�����ӷ���ʽΪ10Al+6NO3��+18H2O=10Al��OH��3+3N2��+6OH�����������ڿ��������չ������漰����ط�Ӧ����ʽΪ4Al+ 3O2 2 Al2 O3��2Al(OH)3
2 Al2 O3��2Al(OH)3 Al2 O3+3 H2O����3��H2����ԭ����ˮ��NO3������Ӧ�еĻ�ԭ���������������ɲ������ѭ���������Ϊˮ�͵������÷�ӦΪ5H2+2NO3��
Al2 O3+3 H2O����3��H2����ԭ����ˮ��NO3������Ӧ�еĻ�ԭ���������������ɲ������ѭ���������Ϊˮ�͵������÷�ӦΪ5H2+2NO3�� N2+4H2O+2OH������4����ͼ��֪����һ���Ȼ�ѧ��ӦΪNH4+��aq��+1.5O2��g��=2H+��aq��+NO2�� ��aq��+H2O��l����H=��2736 kJ?mol��1�٣��ڶ����Ȼ�ѧ��ӦΪNO2�� ��aq��+0.5O2��g��=NO3�� ��aq������H=��73kJ?mol��1�ڣ��ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3�� ��aq�����Ȼ�ѧ����ʽΪNH4+��aq��+2O2��g��=2H+��aq��+NO3�� ��aq��+H2O��l����H=��346 kJ?mol��1����5������a���ڵ��ʱ����������ӵģ���ӦʽΪAl3++3e-= Al��
N2+4H2O+2OH������4����ͼ��֪����һ���Ȼ�ѧ��ӦΪNH4+��aq��+1.5O2��g��=2H+��aq��+NO2�� ��aq��+H2O��l����H=��2736 kJ?mol��1�٣��ڶ����Ȼ�ѧ��ӦΪNO2�� ��aq��+0.5O2��g��=NO3�� ��aq������H=��73kJ?mol��1�ڣ��ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3�� ��aq�����Ȼ�ѧ����ʽΪNH4+��aq��+2O2��g��=2H+��aq��+NO3�� ��aq��+H2O��l����H=��346 kJ?mol��1����5������a���ڵ��ʱ����������ӵģ���ӦʽΪAl3++3e-= Al��
���㣺��������Ϣ����ʽ����������ԭ��Ӧ�����ӷ�Ӧ���Ȼ�ѧ��Ӧ��ע�ضԻ�ѧ����Ŀ��飬ע��֪ʶ����Ŀ��Ϣ�Ľ������𣬶�ѧ������Ҫ��ϸߡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ��ɫ��Һ�����п��ܺ���Fe3����Al3����Fe2����Mg2����Cu2����NH4+��K����CO32����SO42���������еļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�����ĸ�ʵ�飺
��պȡ��Һ������ɫ��Ӧ(����ɫ�ܲ���)����ɫ��
�ڼ��������ữ���Ȼ�����Һ�����ְ�ɫ������
�ۼ���������ƹ��壬������ɫ��ζ������Ͱ�ɫ������
��ȡ100 mL����Һ��μ��������5 mol��L��1����������Һ�����ɰ�ɫ����������������Ƶ�����ͼ��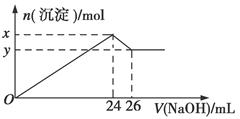
(1)ԭ��Һ��һ�������ڵ����ӣ�____________________________��
(2)Ϊ������Һ��һ�����ڵ�����Ҫ��һ����ܽ����ֳ��������ʣ��仯ѧʽΪ________��________��
x��y��________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ͭ���ʼ��仯������Ӧ�ü���㷺�����ʡ�
(1)ͭ�������������������ᷢ���û���Ӧ����������ͭ����Ũ������У����п�ȼ�����弰��ɫ�������ɣ���֪�����ԣ�Cu2��>I2����ͭ������ᷴӦ�Ļ�ѧ����ʽΪ____________________________________________________��
(2)��֪Cu2O�����ڴ�����Һ�������У�ͬʱ�õ���ɫ��Һ�ͺ�ɫ���壬��Cu2O��ϡ���ᷴӦ�����ӷ���ʽΪ____________________________________��
Cu2O��ϡ���ᷴӦ�����ӷ���ʽΪ_____________________________��
ֻ��ϡ������ȷ��ij��ɫ������ Cu2O��Cu��ɵĻ����ķ�������ȡm g�ú�ɫ������������ϡ�����У���ַ�Ӧ����ˣ�Ȼ��___________________��
(3)Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ��װ����ͼ��ʾ������ܷ�Ӧ��2Cu��H2O���,Cu2O��H2������ʯīӦ���Դ��________��������ͭ�缫�ϵĵ缫��ӦʽΪ________���������У���������Χ��ҺpH________(��������С�����䡱)��
(4)����Cu��Cu2O��CuO��ɵĻ�����м���1 L 0.6 mol/L HNO3ǡ��ʹ������ܽ⣬ͬʱ�ռ���2 240 mL NO(��״��)�����������������������������ԭ�����ù��������Ϊ________����������к���0.1 mol Cu�����û������ϡ�����ַ�Ӧ������������������ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij��ɫ����Һ�п��ܺ���Ag+��Fe3+��K+��Ba2+��NH4+�������ӡ�ijͬѧ��������ʵ�飺
I�����������ϡ���ᣬ�а�ɫ�������ɡ�
II�����ˣ�ȡ������Һ�������м��������ϡ���ᣬ���а�ɫ�������ɡ�
III����ȡ��������II�е���Һ������NaOH��Һ����Һ�ʼ��ԣ����ȣ��ɲ���ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����塣
��1������Һ��һ�����е�������__________��һ�������е�������___________��
��2������III�в�����������ӷ���ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��̽�ն�Ա���������ᣬ��С���߽��˻�ѧ�Թ�����֪�����߳�������Ϊ�Թ������ࡰ���˵�Ұ�ޡ������������ᷴӦ�����ʣ����������ܿ����ǣ��������ͨ����
�����Ҫ�������к��������Ϻ��ʵ����
��1�����Թ��в�����ϡ���ᷴӦ�����ʣ����ڵ���ʵ���_______________�����ڷǵ���ʵ���______________��
��2�����Թ��е����ʣ�����ϡ���ᷢ��������ԭ��Ӧ����
��3������������߳��Թ�HCl��?��___��____��____��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����Ũ�ȷֱ�Ϊ1 mol/L��FeCl3��FeCl2��CuCl2�����Һ100 mL������һ���������ۣ������������ա�
��1����ַ�Ӧ�������Һ�л���һ������Cu2��������Һ��һ�����еĽ������ӻ���___________������������Һ�е����ʵ�����ΧΪ________________�����ܺ��еĽ������������Ϊ____________��
��2����Ӧ��Ϻ�������ʣ�࣬��Һ��һ�����еĽ�������Ϊ___________��Ϊ______mol��
һ��û�еĽ�������Ϊ______________��
��3������FeCl3��Һ�м�����������ᣬ������Ӧ�����ӷ���ʽΪ____________________��
��4��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�S��H2S��HNO3��NO��H2O���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________������Ӧ������ת����0.3mol���ӣ������������������___________g�����ɵ������ڱ���µ������________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ��ɫ������Һ��Ҫȷ���Ƿ����������ӣ�K����Mg2����Al3����Fe2����Ba2����NO3����SO42����Cl����I����HCO3����ȡ����Һʵ�����£�
| ʵ�鲽�� | ʵ������ |
| ��1��ȡ��������Һ���Ӽ��μ��� | ��Һ���ɫ |
| ��2��ȡ��������Һ����Ũ������CuƬ��ŨH2SO4������ | ����ɫ����������������������Ա�ɺ���ɫ |
| ��3��ȡ��������Һ����BaCl2��Һ | �а�ɫ�������� |
| ��4��ȡ��3�����ϲ���Һ����AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����HNO3 |
| ��5��ȡ��������Һ����NaOH��Һ | �а�ɫ�������ɣ���NaOH����ʱ���������ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
д�����л�ѧ����ʽ�����ӷ���ʽ����뷽��ʽ��
��1��̼������Һ�����Ĵ�����Һ��Ӧ�����ӷ���ʽ��
��2��þ�ڶ�����̼������ȼ�գ���ѧ����ʽ��
��3����������루���뷽��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Ϊ�˳�ȥKCl��Һ��������Mg2����SO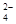 ����ѡ��Ba(OH)2��HCl��K2CO3�����Լ��������²��������
����ѡ��Ba(OH)2��HCl��K2CO3�����Լ��������²�������� 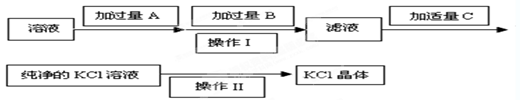
��1�������Լ��У� B�� ��C�� ��
(2)������������� ��
(3)�ӹ���Aʱ�����йط�Ӧ�����ӷ���ʽΪ �� ��
��һ����ɫϡ��Һ�п��ܺ���Na+��Fe3+��H+��Mg2����CO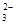 ��OH����HCO
��OH����HCO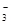 ��Cl���������е������֡�Ϊ��ȷ����Һ����ɣ����������²�����
��Cl���������е������֡�Ϊ��ȷ����Һ����ɣ����������²�����
����ʯ����ֽ����Һ������ԣ���ֽ����ɫ��
��ȡ2������Һ���ȼ�����ϡ�����ữ��������������ټ��Ȼ�����Һ���м��飬û����������
��1��ԭ��Һ��һ�����ڵ������� ��һ�������ڵ������� ��
��2�������������������ܿ϶��Ƿ���ڵ������� ���������һ����ʵ�鷽�����ж��Ƿ�����������ӡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com