
分析 (1)Ⅰ、海水晒盐通过蒸发、结晶制取食盐;
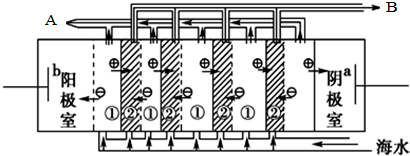
Ⅱ、阳离子交换膜只能阳离子通过,阴离子和气体不能通过;
(2)Ⅰ、海水中含有的Mg2+和Ca2+等阳离子易和氢氧根离子反应生成沉淀;
Ⅱ、在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,离子浓度大的为浓水,离子浓度小的为淡水;
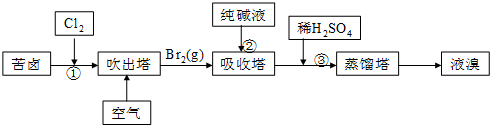
(3)Ⅰ、吸收塔中碳酸根离子与溴单质反应生成溴离子、硝酸根离子和二氧化碳气体,据此写出反应的离子方程式;
Ⅱ、在①中溴单质浓度较小,通过吹出、吸收、酸化重新获得含Br2的溶液,可以富集溴,降低成本;
Ⅲ、温度过高会导致水蒸气蒸发出来,温度过低无法将溴蒸发出来.
解答 解:(1)Ⅰ、海水晒盐需要通过蒸发、结晶过程,所以还需要结晶池,故答案为:结晶;
Ⅱ、阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,
故答案为:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯等;
(2)Ⅰ、海水中含有海水中含较多Mg2+和Ca2+等阳离子,电解时阴极附近生成氢氧根离子,导致氢氧根离子和钙镁离子反应生成Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜,从而抑制离子通过,导致电渗析法失败,
故答案为:海水中含较多Mg2+和Ca2+等阳离子,电解时会产生Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜;
②在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度不大,离子浓度大的为浓水,所以浓水在B处排出,淡水在A处排出,
故答案为:浓水;
(3)Ⅰ、纯碱是碳酸钠,与溴反应有BrO3-生成,反应的离子方程式为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑,故答案为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑;
Ⅱ、从①出来的溶液中溴的含量不高,如果直接蒸馏,产品成本高,所以需要进一步浓缩溴,提高溴的浓度,故答案为:富集溴,提高Br2的浓度;
Ⅲ、温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,故答案为:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
点评 本题考查海水的综合利用、海水晒盐、电渗析法淡化海水、从海水中提溴的原理,题目难度中等,明确图片内涵、生成流程为解本题关键,(2)中阳离子在电极上放电,导致排出的水为淡水,从而实现海水淡化.


科目:高中化学 来源: 题型:选择题
| A. | 核外电子是分层运动的,像卫星一样有确定的轨道 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 能量低的电子在离核近的区域运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于100mL | B. | 小于100mL | C. | 等于100mL | D. | 等于100/ρ mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
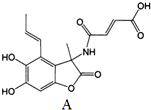
| A. | 化合物M的分子式为C16H15NO7 | |
| B. | 1 mol M在NaOH溶液中反应,最多消耗4 mol NaOH | |
| C. | 化合物M能发生加成反应,不能发生消去反应 | |
| D. | 化合物M能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

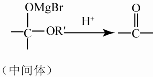
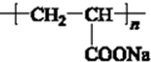

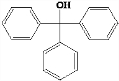 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4g乙醛分子中含有的共用电子对数为0.6NA | |
| B. | 标准状况下,11.2L二氯甲烷所含分子数为0.5NA | |
| C. | 15.6g苯中含有碳碳双键的个数为0.6NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com