
分析 用a表示出分解的n(KClO3)及分解后剩余n(KClO3),根据方程式可得分解得到的n(KCl)、n(O2),再根据KClO3+5KCl+3H2SO4═3Cl2+3K2SO4+3H2O计算解答.
解答 解:分解的n(KClO3)=ma mol,剩余的n′(KClO3)=m(1-a)mol,
2 KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2 KCl+3 O2↑
ma mol ma mol 1.5ma mol
由KClO3+5KCl+3H2SO4=3Cl2↑+3K2SO4+3H2O,可知m(1-a)mol:ma mol=1:5,解得a=$\frac{5}{6}$,
根据氯元素守恒:n(Cl2)=0.5m mol,故O2和Cl2的总物质的量为:0.5m mol+1.5m mol×$\frac{5}{6}$=1.75m mol,即n=1.75m,
答:氯元素全部转化为Cl2时a=$\frac{5}{6}$、n=1.75m.
点评 本题考查混合物计算、化学方程式计算,侧重考查学生的分析计算能力,难度中等.


科目:高中化学 来源: 题型:填空题
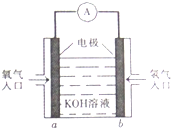 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从a、b两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从a、b两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHCO3和MgCO3 | B. | MgCO3和SiO2 | C. | K2CO3和 SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 | B. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 | ||
| C. | CH2═CH-CH═CH2和 | D. |  和 和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中,A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水硫酸铜粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液.(提示:乙醇催化氧化产物与新制Cu(OH)2悬浊液共热有砖红色沉淀生成)
如图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中,A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水硫酸铜粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液.(提示:乙醇催化氧化产物与新制Cu(OH)2悬浊液共热有砖红色沉淀生成)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的丁达尔效应与微粒直径大小有关 | |
| B. | 电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 | |
| C. | CaO的水溶液能够导电,因此Ca0是电解质 | |
| D. | 向饱和氯化钠溶液中加人一小块钠,溶液中有固体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com