
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
分析 I.(1)氯气与水反应生成HCl与HClO,HClO不稳定分解为HCl与氧气;
(2)增大压强,平衡向气体体积减小的方向移动;
Ⅱ.(1)根据v=$\frac{△c}{△t}$计算v(O2);
(2)A.等效为开始加入4mol SO3(g),与原平衡为完全等效平衡,平衡时相同物质的浓度相等;
B.等为在原平衡的基础上加入1.5molSO2,与原平衡相比,平衡逆向移动;
C.等效为在原平衡基础上,体积增大一倍,压强减小一倍,平衡正向移动,三氧化硫的转化率增大;
D.等效为开始加入4mol SO3(g)、2molO2,进一步等效为在原平衡的基础上加入2molO2,抑制SO3分解.
解答 Ⅰ.(1)氯气与水反应:H2O+Cl2?HCl+HClO,HClO不稳定分解:2HClO═2HCl+O2↑,氯水久置后会变质,
故答案为:氯气与水反应:H2O+Cl2?HCl+HClO,HClO不稳定分解:2HClO═2HCl+O2↑;
(2)存在平衡:H2O+Cl2?HCl+HClO,增大压强,平衡向气体体积减小的方向移动,氯气的溶解度增大,故答案为:增大;
Ⅱ.(1)反应至4min时,氧气的浓度为0.5mol/L,0min~4min内生成O2的平均速率v(O2)=$\frac{0.5mol/L}{4min}$=0.125mol/(L•min),故答案为:0.125;
(2)A.等效为开始加入4mol SO3(g),与原平衡为完全等效平衡,平衡时相同物质的浓度相等,即三氧化硫浓度为0.04mol/L,故A不符合;
B.等为在原平衡的基础上加入1.5molSO2,与原平衡相比,平衡逆向移动,三氧化硫浓度大于0.04mol/L,故B符合;
C.等效为在原平衡基础上,体积增大一倍,压强减小一倍,平衡正向移动,三氧化硫的转化率增大,三氧化硫浓度小于0.02mol/L,故C不符合;
D.等效为开始加入4mol SO3(g)、2molO2,进一步等效为在原平衡的基础上加入2molO2,抑制SO3分解,三氧化硫浓度大于0.04mol/L,故D符合,
故选:BD.
点评 本题考查等效平衡、化学平衡影响因素、反应速率计算等,难度中等,注意利用等效思想进行分析解答.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
按照冶金工业的分类,下列合金属于黑色金属材料的是( )
A.锰钢 B.青铜 C.铝锂合金 D.镧镍储氢合金
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 浓度为0.06mol/L.
浓度为0.06mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
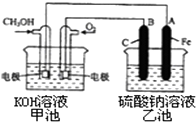 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
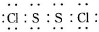 ,它不稳定,在水中易发生岐
,它不稳定,在水中易发生岐| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
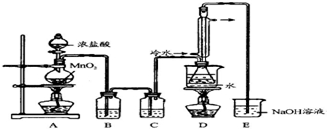
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL的烧杯量取14.80mL NaOH溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.20g NaCl | |
| D. | 用100mL容量瓶配制80mL 0.1mol/L的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com