
分析 (1)根据某α-Fe催化剂中FeO和Fe2O3的物质的量相等,计算其中Fe2+与Fe3+的物质的量之比;
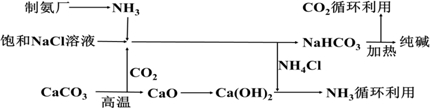
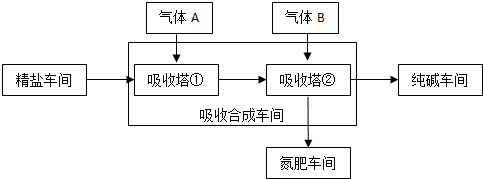
(2)为了增大二氧化碳的溶解性,所以向饱和NaCl溶液中先通入NH3,后通入CO2,效果更好,氯化钠、二氧化碳、氨气和水反应生成NaHCO3沉淀和NH4Cl;
(3)根据索尔维制碱法的流程使用CaCO3制备CO2,最后用氢氧化钙与氯化铵反应生成氨气循环,同时生成氯化钙废渣;而侯氏制碱法在得到纯碱的同时还制得了NH4Cl,可以作氮肥.
解答 解:(1)某α-Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比1:2,故答案为:1:2;
(2)为了增大二氧化碳的溶解性,所以向饱和NaCl溶液中先通入NH3,后通入CO2,效果更好,发生反应的方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,故答案为:NH3; NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)根据索尔维制碱法的流程使用CaCO3制备CO2,最后用氢氧化钙与氯化铵反应生成氨气循环,同时生成氯化钙废渣;而侯氏制碱法不再使用CaCO3制备CO2,在得到纯碱的同时还制得了NH4Cl,所以物质在农业上的用途是可以作氮肥,故答案为:CaCl2;NH4Cl;作氮肥.
点评 本题考查了纯碱工业制备原理分析比较,反应实质的应用,试剂的作用,理解生产原理和过程的实质是解答的关键,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 32g氧气中含有2mol氧 | |
| C. | 58.5gNaCl中含有l mol NaCl分子 | |
| D. | 0.l mol二氧化碳含有6.02×1022个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离成Na+ 和Cl- | |
| B. | 蔗糖在水溶液里或熔融状态时均不导电,所以它不是电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
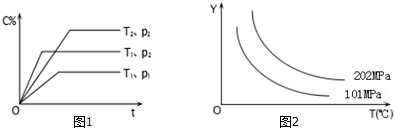
| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的质量分数 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气中C的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,Na2CO3溶液中各种离子的浓度均增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的体系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 1 | 2 | 3 | 4 |
| 反应物投入量 (始态) | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH的平衡浓度/mol•L-1 | c1 | c2 | c3 | c4 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ | 放出 w kJ |
| 体系压强/Pa | p1 | p2 | p3 | p4 |
| 反应物转化率 | a1 | a2 | a3 | a4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
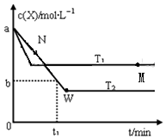 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点时再加入一定量的X,平衡后X的转化率增大 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol/(L•min) | |
| C. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点吸收的热量小于进行到W点放出的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com