
����Ŀ���ױ�(![]() )��һ����Ҫ�Ļ���ԭ�ϣ���������������ȩ(
)��һ����Ҫ�Ļ���ԭ�ϣ���������������ȩ(![]() )��������(
)��������(![]() )�Ȳ�Ʒ���±��г����й����ʵIJ����������ʣ���ش�
)�Ȳ�Ʒ���±��г����й����ʵIJ����������ʣ���ش�
���� | ��״ | �۵㣨�棩 | �е㣨�棩 | ����ܶ� ����ˮ=1g/cm3�� | �ܽ��� | |
ˮ | �Ҵ� | |||||
�ױ� | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.8660 | ���� | ���� |
����ȩ | ��ɫҺ�� | -26 | 179 | 1.0440 | �� | ���� |
������ | ��ɫƬ״����״���� | 122.1 | 249 | 1.2659 | �� | ���� |
ע���ױ�������ȩ�������������ܡ�
ʵ���ҿ�����ͼװ��ģ���Ʊ�����ȩ��ʵ��ʱ��������ƿ�м���0.5g��̬�����Դ������ټ���15mL������(��Ϊ�ܼ�)��2mL�ױ�������������70�棬ͬʱ��������12mL�������⣬�ڴ��¶��½��跴Ӧ3Сʱ��

��1��װ��a��������__________________����Ҫ������____________________��
��2������ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________________���˷�Ӧ��ԭ�������������Ͽɴ�___________����ԭ��������=(���������������/ȫ����Ӧ���������)��100%��
��3�����ⶨ����Ӧ�¶�����ʱ���ױ���ת�����������¶ȹ���ʱ������ȩ�IJ���ȴ�������٣����ܵ�ԭ����________________________________________________��
��4����Ӧ��Ϻ�Ӧ���Һ������Ȼ��ȴ������ʱ����Ӧ���� ________��________(���������)�Ȳ��������ܵñ���ȩ�ֲ�Ʒ��
��5��ʵ���м���������������ҷ�Ӧʱ��ϳ�����ʹ����ȩ��Ʒ�в����϶�ı����ᡣ����ӻ��б�����ı���ȩ�з���������ᣬ��ȷ�IJ���������_______(������˳������ĸ)��
a.�Ի��Һ���з�Һ b.���ˡ�ϴ�ӡ�����
c.ˮ���м����������pH��2 d.��������̼��������Һ�����
���𰸡����������� ������������ֹ�ױ��Ļӷ������Ͳ�Ʒ���� 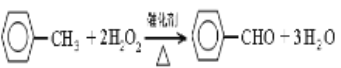 66.25�� H2O2�ڽϸ��¶�ʱ�ֽ��ٶȼӿ죬ʹʵ�ʲμӷ�Ӧ��H2O2���٣�Ӱ����� ���� ���� dacb
66.25�� H2O2�ڽϸ��¶�ʱ�ֽ��ٶȼӿ죬ʹʵ�ʲμӷ�Ӧ��H2O2���٣�Ӱ����� ���� ���� dacb
��������
(1) װ��a�����������������ܡ��ɱ����֪�ױ��ӷ�������Ӧ�¶�Ϊ700C�����û�������ܣ��ױ�������ӷ����뿪��Ӧ��ϵ������ȩ�IJ��ʾͻή�͡�����a��Ҫ������������������ֹ�ױ��Ļӷ������Ͳ�Ʒ���ʡ�
(2)����������п�֪����Ӧ���Ǽױ��������⣬�����DZ���ȩ���ӹ����ű仯������Ӧ�������л����Ӽ���ԭ�ӣ������л�������Ӧ���ص㣬�־���ѧ֪ʶ�����������������ԣ����Դ˷�Ӧ�Ǽױ���������������Ϊ����ȩ�Ĺ��̡���ѧ����ʽΪ��![]() +2H2O2
+2H2O2![]()
![]() +3H2O������ȩ����Է�������Ϊ106������ԭ�������ʵļ��㹫ʽ���㣺ԭ��������=
+3H2O������ȩ����Է�������Ϊ106������ԭ�������ʵļ��㹫ʽ���㣺ԭ��������=![]() ��100%=
��100%=![]() ��100%=66.25%��
��100%=66.25%��
(3)��Ϊ�¶����߷�Ӧ���ʼӿ죬��Ӧ����֣������ʵ����߷�Ӧ�¶ȣ��ױ���ת���������¶ȹ��ߣ���������ֽ�ӿ�2H2O2![]() 2H2O+O2
2H2O+O2![]() ��ʹ�������������ױ�������С������ȩ�IJ������͡�
��ʹ�������������ױ�������С������ȩ�IJ������͡�
(4)��Ӧ������Ļ�����к������ܵĹ��������δ��Ӧ�ļױ�������������Ʒ����ȩ���ܼ������ᡢ����ˮ���ȹ����Գ�ȥ���ܵĹ����������Ϊ�ױ��������ᡢˮ�ķе㶼�ȱ���ȩ���е�1790C�������������������ֽ⣬�������¶ȵ���1790C����������������Һ��Ϊ����ȩ�ֲ�Ʒ���𰸣����� ����
(5)��������ת��Ϊ������ˮ�ı������ƣ�����ȩ������������ˮ��Һ̬���ʣ�ͨ����Һ��ȥ����ȩ������ˮ���DZ���������Һ���ټ���ʹ��������ת��Ϊ�����ᣬ�����᳣��������ˮ�Ĺ������ʣ����˵õ���������Ϊ�����ᣬ������ȷ�IJ������裺dacb��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
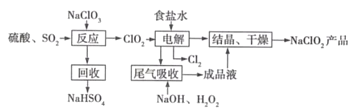
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£�
�ش��������⣺
��1��NaClO2��Cl�Ļ��ϼ�Ϊ_______��
��2��д������Ӧ������������ClO2�Ļ�ѧ����ʽ_______��
��3�������������ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�Ϊ________��________�����������������Ӧ����Ҫ������______��
��4����β��������������������������ų�������ClO2�������շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________���÷�Ӧ������������_________��
��5������Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺��������������������൱�ڶ��ٿ�Cl2������������NaClO2����Ч�Ⱥ���Ϊ____����������������λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����мס��ҡ�������ͬѧ�ֱ����Fe��OH��3������Ʊ�ʵ�飮
I����ͬѧ��1molL��1�Ȼ�����Һ�м���������NaOH��Һ��
II����ͬѧֱ�Ӽ��ȱ���FeCl3��Һ��
III����ͬѧ��25ml��ˮ����μ���5��6��FeCl3������Һ�������������Һ�ʺ��ɫ��ֹͣ���ȣ� �Իش��������⣺
��1�����в�����ȷ��ͬѧ��_____��д���˹����еĻ�ѧ����ʽ��_____________��
��2��֤����Fe��OH��3�������ɵ����ʵ�������___________________________��
��3��Fe��OH��3�����Dz��ǵ���ʣ�_____ ����ǡ����ǡ�����
��4����ͬѧ�������Ƶõ�Fe��OH��3�����������ʵ�飺
�ٽ���װ��U�ι��ڣ���ʯī���缫����ֱͨ���磬ͨ��һ��ʱ�����������������ɫ��������Fe��OH��3������_____��ɣ�
�������м��뱥��Na2SO4��Һ��������������_________________________________��
��������Fe��OH��3��������εμ�������Һ����ʼ�������ɫ������������Ϊ_____�������μӣ�����������ʧ�ҵ��ػ�ɫ��Һ��д����ѧ����ʽ______________________��
������ȥFe��OH��3�����л��е�NaCl������������Ʒ��_____������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪KMnO4��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ��2KMnO4+16HCl��Ũ����2MnCl2+8H2O+2KCl+5Cl2�����ش��������⣺
��1������˫���ű�ʾ���÷�Ӧת�Ƶ��ӵķ������Ŀ_______________________________
��2����������HClռHCl������_______ ����ԭ��Ԫ��_________����Ԫ�ط��ţ�
��3������״������0.5mol��������ʱ���÷�Ӧת�Ƶĵ�����Ϊ_____����NAΪ�����ӵ�������ֵ��
��4��15.8g KMnO4�뺬1.2molHCl��Ũ������ȫ��Ӧ������HCl�ӷ������ڷ�Ӧ�����Һ�м���������AgNO3��Һ��������_____g������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���о����Ʊ�����ˮ�ɷݵ�ʵ���У�����ʵ������ó��Ľ��۲���ȷ���ǣ� ��
A. ��ˮ����ɫ��dz����ɫ��˵����ˮ�к���Cl2
B. ����ˮ�еμ������ữ��AgNO3��Һ��������ɫ������˵����ˮ�к���CI-
C. ����ˮ�м���NaHCO3��ĩ�������ݲ�����˵����ˮ�к���H+
D. ����۵⻯����Һ�еμ�������ˮ����Һ������˵����ˮ�к���ClO-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��A��ͨ��������������B����C���ĺ첼������ɫ���ر�B��ʱ��C���ĺ첼������������������Dƿ��װ���ǣ� ��

A. Ũ����B. ŨNaOH��Һ
C. Ũ����D. ����NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�m g����A��n g����B�ķ�������ͬ������˵���в���ȷ����
A. ��������A��B����Է�������֮��Ϊm��n
B. ͬ��������A��B�ķ�����֮��Ϊn��m
C. ͬ��ͬѹ�£�A��B��������ܶ�֮��Ϊn��m
D. ��ͬ״���£�ͬ���A��B�����������֮��Ϊm��n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭҺ�������һ�ֵͳɱ��Ĵ��ܵ�أ���ؽṹ��ͼ��ʾ������ԭ��ΪFe3++Cr2+![]() Fe2++Cr3+������˵����ȷ����
Fe2++Cr3+������˵����ȷ����

A. ��س��ʱ��b���ĵ缫��ӦʽΪCr3++e-=Cr2+
B. ��س��ʱ��Cl-��a������ѡ������Ĥ����b��
C. ��طŵ�ʱ��a���ĵ缫��ӦʽΪFe3++3e-=Fe
D. ��طŵ�ʱ����·��ÿͨ��0. 1 mol���ӣ�Fe3+Ũ�Ƚ���0. 1 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�Һ�°����NaHCO3�ܽ�ȱ�NaCl��Na2CO3��NH4HCO3��NH4Cl��С�����ʣ�����CO2+NH3+H2O+NaCl=NaHCO3��+NH4Cl�ķ�Ӧԭ���Ʊ������������ʵ���ҽ���ģ��ʵ�����������ʾ��ͼ��
����������������ǣ�����
A. A������NH3��B������CO2
B. �Ѵ���ڢõ��ľ�����ijЩ�����������ʣ����ʯ�ᣩ��Ͽ��Ƶ÷��ͷ�
C. ����ɹ㷺�����ڲ�������������ֽ����֯�ȹ�ҵ��
D. �ڢ��������ǽ���������ˮ����ȡ��������ᾧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com