
| A. | 标准状况下,22.4 L H2O中含有氢原子数目为2NA | |
| B. | 17 g NH3所含质子数为10NA | |
| C. | 0.1mol Cu(NO3)2中含有的离子数目为0.2NA | |
| D. | 28g N2 体积为22.4L |
分析 A.标准状况下,水的状态不是气态;
B.氨气分子中含有10个质子,根据n=$\frac{m}{M}$计算出氨气的物质的量,再计算出含有质子的物质的量及数目;
C.0.1mol硝酸铜中含有0.1mol铜离子和0.2mol硝酸根离子;
D.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算.
解答 解:A.标准状况下水不是气体,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.17g氨气的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气分子中含有10mol质子,所含质子数为10NA,故B正确;
C.0.1mol Cu(NO3)2中含有0.1mol铜离子和0.2mol硝酸根离子,总共含有0.3mol离子,含有的离子数目为0.3NA,故C错误;
D.不是标准状况下,不能使用标准状况下的气体摩尔体积计算氮气的体积,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的计算与应用,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:实验题
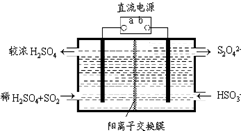 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | T1<T2,Q>0 | |
| B. | 增大压强,B的转化率减小 | |
| C. | 当混合气体的密度不再变化,反应达平衡状态 | |
| D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
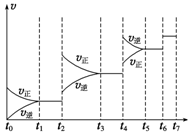 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
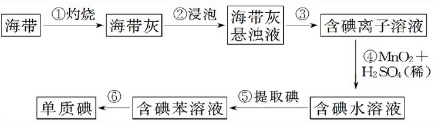
| 密度(g/cm3) | 熔点(.C) | 沸点(.C) | |
| 碘 | 4.93 | 113.5 | 184.35 |
| 苯 | 0.885 | 80.10 | 5.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与水能以任意比互溶 | B. | 醋酸溶液能导电 | ||
| C. | 醋酸溶液中存在醋酸分子 | D. | 醋酸能和碳酸钙反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
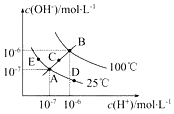 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、Na+、K+ | B. | SO42-、Cl-、K+ | C. | Cl-、NO3-、K+ | D. | HCO3-、SO42-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com