
【题目】含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4四种常见的含硫化合物。回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是________.
A.S2- B.S C.SO32- D.SO42-
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性。所选试剂是_______,该反应的离子方程式为 .
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面___________,则发生了钝化;若铁棒表面_____________,则未发生反应。
(4)用铜制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式
最佳途径是_______(填序号),理由是
【答案】(1)D;(2)溴水;SO32-+Br2+H2O=2H++SO42-+2Br-;(3)无明显现象(填“无现象”也可) 有紫红色物质析出;(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;②;原料利用率高,环境污染小。
【解析】
试题解析:(1)酸性高锰酸钾具有强氧化性,SO2以还原性为主,两者发生氧化还原反应,+4价S→+6价,即选项D正确;(2)证明Na2SO3具有还原性,要有明显的现象说明,溴水具有强氧化性,溴水褪色,说明亚硫酸具有还原性,发生:SO32-+Br2+H2O=2H++SO42-+2Br-;(3)如果发生钝化反应,在铁表面产生铁的氧化物,铁的氧化物不与CuSO4反应,故无现象,如果铁和浓硫酸不反应,利用铁的金属性强于铜,在铁棒表面产生红色物质;(4)NO3-在H+条件现具有强氧化性,其离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;途径①有NO生成,对环境有污染,途径②发生的离子反应:2Cu+O2+4H+=2Cu2++2H2O,无污染,原料利用率高,途径③铜和只跟浓硫酸反应,随着反应的进行,反应将会停止,同时此反应产生SO2,对环境有污染。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
|
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱如下图: |
|
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于①乙烯 ②苯 ③乙醇 ④乙酸 ⑤葡萄糖等有机物的叙述不正确的是
A. 可以用新制的Cu(OH)2悬浊液来鉴别③④⑤
B. ①③⑤能使酸性KMnO4溶液褪色
C. ②③④能发生取代反应,①⑤不能发生取代反应
D. 一定条件下,⑤可用于生产③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为 ,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因 ;
溶液中离子浓度由大到小的顺序为
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:

(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式 ;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明 。
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)化合物H是合成抗心律失常药物决奈达隆的一种中间体,可通过以下方法合成:
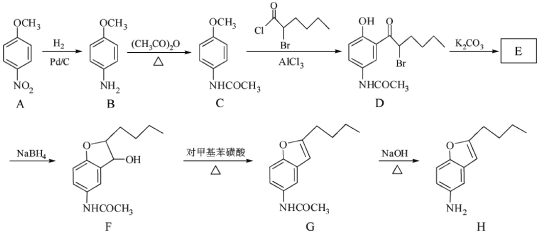
(1)D中的含氧官能团名称为____________(写两种)。
(2)F→G的反应类型为___________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式:___________。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化
②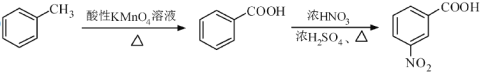
请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)常温下,现有A、B、C、D四种电解质分别完全溶于水,所得四种溶液中含H+、Ba2+、Al3+、Na+、HCO3-、Cl-、OH-、SO42-八种离子(不考虑水解)。为了检验这四种物质,进行如下实验:
①取少量A的溶液分别与另三种物质反应,依次观察到:白色沉淀和气体、气体、白色沉淀。
②经测定,A和D的溶液显碱性,B和C的溶液pH<7。B与D的溶液反应产生两种沉淀,当D的量增大时,其中一种沉淀不断溶解,最终还存在一种沉淀。
③C与D的溶液反应,无明显现象。经测定,该反应的产物总能量小于反应物总能量。
根据上述实验事实,请回答下列问题:
(1)C的名称是________,D的化学式_________。
(2)用离子方程式表示A的溶液显碱性的原因:_________________。
(3)A与B在溶液中反应的离子方程式为________________。
(4)等物质的量浓度、等体积的B和D的溶液混合,写出反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃X完全燃烧时,生成的n(H2O)=n(CO2),X不能使溴水褪色。X的分子式可能是
A.C2H2 B.C2H4 C.C3H4 D.C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)毗氟氯禾灵的合成路线如下:

已知:![]()
(1)B的结构简式为_____________。A的系统名称为_____________。
(2)在合成吡氟氯禾灵所涉及的反应中,属于加成反应的有___________(填序号)。
(3)写出反应⑥的化学方程式___________________。
(4)C的同分异构体有多种,写出同时具有下列性质的同分异构体的结构简式___________________。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应 c.核磁共振氢谱图中有四组峰
(5)写出由![]() 制备高分子化合物
制备高分子化合物![]() 的合成路线流程图(无机试剂任选),合成流程示意图如下:
的合成路线流程图(无机试剂任选),合成流程示意图如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃ ),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:① 四氯化硅遇水极易水解;② SIC14沸点为57.7℃ ,熔点为-70.0℃ 。请回答:
(1)写出装置A 中发生反应的离子方程式_______________。
(2)装置C 中的试剂是___________;装置F的作用是_______________;
装置E 中的h 瓶需要冷却的理由是_______________。
(3)装置E 中h 瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
① 反应的离子方程式:_______________。② 滴定前是否要滴加指示剂?_______________。(填“是”或“否”) ,请说明理由_______________。
③ 滴定前检验Fe3+ 是否完全还原的实验操作是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com