
分析 ①3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,以此来解答;
②S+2KNO3+3C═K2S+N2↑+3CO2↑中,N、S元素的化合价降低,C元素的化合价升高,以此来解答;
③反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O中,Cl元素的化合价由0降低为-1价,由0升高为+5价,以此来解答.
解答 解:①在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,硝酸中N元素得电子被还原,作氧化剂,如果有8mol硝酸参加反应,则有2mol硝酸参加氧化还原反应,所以未被还原的硝酸与参加反应的总硝酸的质量比为6:8=3:4;
故答案为:3:4;
②S+2KNO3+3C═K2S+N2↑+3CO2↑中,N、S元素的化合价降低,则氧化剂为S、KNO3,生成K2S、N2为还原产物,C元素的化合价升高,则还原剂为C,故答案为:C;K2S、N2;
③3molCl2完全反应电子转移3mol×2×$\frac{5}{6}$(1-0)=5mol,故答案为:5.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
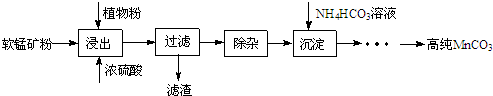
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH | |
| D. | 镀层破损后,镀锌铁板比镀锡铁板更易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
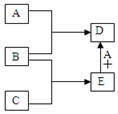 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
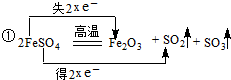 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 65 | 249 | 199.6 |
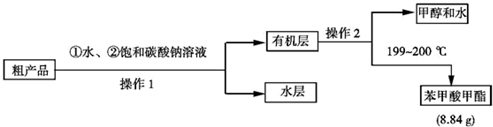
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是 | |
| 检验粗产品中含有硫酸的操作是 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com