
【题目】按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2OH3O++OH﹣ , 则液态NH3电离的方程式是
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=10,则该温度下水的KW= , 在此温度下,将pH=b的NaOH溶液Vb L与pH=a的H2SO4溶液Va L混合,若所得混合液为中性,且a+b=13,则Va:Vb=
(3)25℃时,0.1mol/L的HA溶液中 ![]() =1010 . 请回答下列问题:
=1010 . 请回答下列问题:
①HA是(填“强电解质”或“弱电解质”).
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是(填字母)
A.c(HA) B. ![]() C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
(4)在常温下,中和相同体积,相同pH的Ba(OH)2、NH3H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3 , 则三种关系为(用“V1、V2、V3”和“>、<、=”表示).
(5)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是 . (填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是 , 反应所用时间长短关系是
【答案】
(1)2NH3?NH4++NH2﹣
(2)1×10﹣12;10:1
(3)弱电解质;D
(4)V2>V3=V1
(5)B>A=C;A=B=C;A=C>B
【解析】解:(1)依据2H2OOH﹣+H3O+ , 可知液体氨气部分电离出铵根离子和氨基负离子,电离方程式:2NH3NH4++NH2﹣;所以答案是:2NH3NH4++NH2﹣;(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的氢氧根离子的浓度为:10﹣2mol/L,而pH=10,说明溶液中氢离子的浓度为:10﹣10mol/L,所以该温度下水的KW=10﹣2mol/L×10﹣10mol/L=1×10﹣12;混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等,pH=b的NaOH溶液中氢氧根离子浓度=10b﹣12 mol/L,pH=a的H2SO4溶液氢离子浓度=10﹣a mol/L,
10b﹣12 mol/L×VbL=10﹣a mol/L×VaL且且a+b=13,则Va:Vb=10:1,
所以答案是:1×10﹣12;10:1;(3)25℃时,0.1mol/L的HA溶液中中 ![]() =1010 , 则c(H+)=1.0×10﹣2mol/L,c(OH﹣)=1.0×10﹣12mol/L,说明HA是弱酸,NaA溶液显碱性,将含0.1molHA的溶液用NaOH溶液滴定至中性,耗NaOH的物质的量小于0.1mol,所以答案是:弱电解质;
=1010 , 则c(H+)=1.0×10﹣2mol/L,c(OH﹣)=1.0×10﹣12mol/L,说明HA是弱酸,NaA溶液显碱性,将含0.1molHA的溶液用NaOH溶液滴定至中性,耗NaOH的物质的量小于0.1mol,所以答案是:弱电解质;
②A、n(H+)和n(A﹣)增大,n(HA)减小,所以c(HA)减小,故A错误;
B、平衡常数只受温度影响,所以 ![]() 不变,故B错误;
不变,故B错误;
C、水的离子积常数只受温度影响,c(H+)与c(OH﹣)的乘积不变,故C错误;
D、弱酸HA加水稀释,溶液酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,故D正确;
所以答案是:D;(4)等体积、等pH的Ba(OH)2、NaOH中,c(OH﹣)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3 ,
但NH3H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2>V3 ,
所以消耗酸的体积关系为:V2>V3=V1 ,
所以答案是:V2>V3=V1;(5)醋酸和盐酸都是一元酸,醋酸是弱酸,盐酸是强酸,硫酸是二元强酸,所以醋酸中存在电离平衡,氯化氢和硫酸完全电离,
①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是:B>A=C,
所以答案是:B>A=C;
②反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,则反应时间大小为:A=C>B,
所以答案是:A=B=C;A=C>B.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法不正确的是
A. 乙烯和苯都能与溴水反应 B. 乙酸和油脂都能与氢氧化钠溶液反应 C. 糖类和蛋白质都是人体重要的营养物质 D. 乙烯和甲烷可用酸性高锰酸钾溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面题目:
(1)由于钠很容易与空气中的二氧化碳和等物质反应,所以钠在自然界里只能以态存在.
(2)维生素C又称为抗坏血酸,在人体内有重要的功能.例如帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+ . 这说明维生素C具有(填氧化性或还原性).
(3)写出下列空格内物质的名称、俗名或化学式:
名称 | 氧化铁 | 碳酸钠 | 碳酸氢钠 |
俗名 | 铁红 | 小苏打 | |
化学式 | Na2CO3 | NaHCO3 |
(4)写出下列电离方程式或化学方程式:①Na2CO3在水溶液中的电离方程式②曾青(CuSO4)得铁化为铜的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.常温下铁与浓硫酸不反应
B.氯化铁溶液可用于印刷电路板的制作
C.贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气
D.久置于空气中的漂白粉会变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学根据苯和四氯化碳互溶、苯的密度比水小、四氯化碳的密度比水大的性质制作了如图所示的“液体积木”。在试管中注入CCl4,再加少量水,再小心加入少量苯,溶液可出现分三层的现象,然后再用漏斗向水层中加入少量胆矾溶液及少量碘水(如图所示)。下列说法正确的是
![]()
A.上中下三层的颜色分别为无色、蓝色、紫色
B.上中下三层的颜色分别为紫色、蓝色、紫色
C.振荡再静置后溶液分为两层,水在下层
D.振荡再静置后溶液仍分为三层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中可能有下列阴离子中的一种或几种:SO![]() 、SO
、SO![]() 、S2-、CO
、S2-、CO![]() 、Cl-。
、Cl-。
①当溶液中有大量H+存在时,则不可能有存在。
②当溶液中有大量Ba2+存在时,则不可能有存在。
③当溶液中有和等阳离子存在时,上述所有阴离子都不可能存在。
④当向溶液中通入足量的Cl2时,离子在溶液中不可能存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂.
(1)MgH2是一种离子化合物,其电子式为 .
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2 , 该反应的化学方程式为 .
(3)已知MgH2的有关热化学方程式如下: MgH2(s)Mg(s)+H2(g)△H1=+74.4 KJmol﹣1;
H2(g)+ ![]() O2(g)═H2O(g)△H2=﹣241.8 KJmol﹣1;
O2(g)═H2O(g)△H2=﹣241.8 KJmol﹣1;
Mg(s)+ ![]() O2(g)═MgO(s)△H3=﹣141.6 KJmol﹣1 .
O2(g)═MgO(s)△H3=﹣141.6 KJmol﹣1 .
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为 .
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为 . 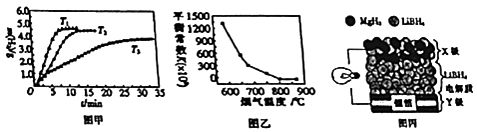
(4)炉膛内脱除SO2与NO的反应为2MgO(s)+2SO2 (g)+2NO(g)2MgSO4(s)+N2(g)△H=a KJmol﹣1 , 其平衡常数与温度的关系如图乙所示. ①上述反应的平衡常数表达式为K= .
②a(填“>”或“<”)0.
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2═Mg+2LiH.放电时,X极的电极反应式为 . 充电时,Y极的电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com