
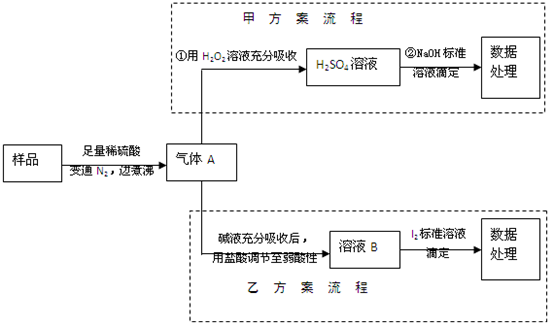
| 64×V×10-5g×1000 |
| w |
| 0.64V |
| w |
| 0.64V |
| w |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
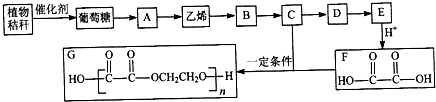
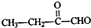 的合成路线流程图(无极试剂任用),合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无极试剂任用),合成路线流程图示例如下:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |
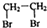
查看答案和解析>>
科目:高中化学 来源: 题型:
| 检验次数 | 溶液中检验出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NH4Cl |
| 第二次 | NH4Cl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、NH4Cl、K2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

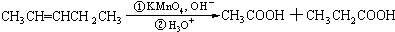
| HBr |
| 过氧化物 |
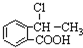 合成
合成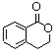 ,写出相关合成流程图(无机试剂任取).
,写出相关合成流程图(无机试剂任取).| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
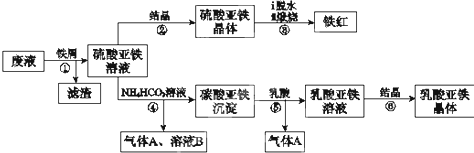
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.80 | 23.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 8 |
| 30 |
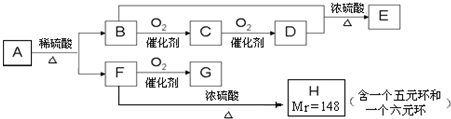
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、所用容量瓶不干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com