
| A. | 2H原子中的中子和质子 | |
| B. | Be2+离子中的质子和电子 | |
| C. | NaHCO3晶体中的阳离子和阴离子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
分析 A.一个2H原子中的中子和质子数都是1;
B.一个Be2+离子中的质子数是4、电子数=4-2=2;
C.NaHCO3晶体的构成微粒是钠离子和碳酸氢根离子;
D.BaO2(过氧化钡)固体中阴阳离子分别是过氧根离子、钡离子.
解答 解:A.一个2H原子中的中子和质子数都是1,所以2H原子中的中子和质子个数比为1:1,故A错误;
B.一个Be2+离子中的质子数是4、电子数=4-2=2,则Be2+离子中的质子数和电子数之比=4:2=2:1,故B正确;
C.NaHCO3晶体的构成微粒是钠离子和碳酸氢根离子,钠离子和碳酸氢根离子之比为1:1,故C错误;
D.BaO2(过氧化钡)固体中阴阳离子分别是过氧根离子、钡离子,过氧根离子和钡离子之比为1:1,故D错误;
故选B.
点评 本题考查晶体结构及核素或离子构成,侧重考查学生分析判断能力,注意CD中物质构成微粒,易错选项是D,该物质是由钠离子和过氧根离子构成的,不是钠离子和氧离子构成的,题目难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④⑤ | C. | ①②⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
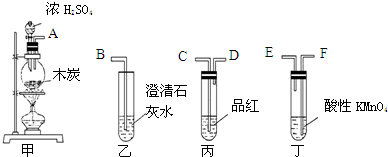
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性保持不变 | B. | 非金属性逐渐增强 | ||
| C. | 金属性逐渐增强 | D. | 非金属性保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| KSP(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| A. | 在pH=5的溶液中.Fe3+不能大量存在 | |
| B. | 混合溶液中c(SO42-):[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5:4 | |
| C. | 向混合溶液中逐滴加入0.1mol•L-1NaOH溶液,最先看到红褐色沉淀 | |
| D. | 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用作食品防腐剂 | |
| B. | 苯酚皂可用于环境消毒,医用酒精可用于皮肤消毒,其原因是它们都可以杀死细菌 | |
| C. | “乙醇汽油”是在汽油中加入乙醇生成的一种新化合物 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com