
| A. | 煤油 | B. | 水 | C. | 汽油 | D. | 四氯化碳 |
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:多选题
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5 mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,过氧化氢
,过氧化氢
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
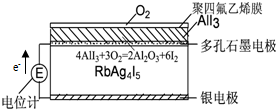
| A. | 电子从银电极在RbAg4I5晶体中迁移流向石墨电极 | |
| B. | Ag+从下往上移动 | |
| C. | 石墨电极为正极,银电极为负极 | |
| D. | 银电极的电极反应是:Ag-e-=Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某气体通入品红溶液中,品红溶液褪色,加热后溶液恢复红色,则该气体一定是SO2 | |
| B. | 钾元素焰色反应的操作:用铂丝蘸取氯化钾置于煤气灯的火焰上进行灼烧,直接观察其焰色 | |
| C. | NH4+的检验:向待检液中加入NaOH溶液并加热,可生成使湿润的蓝色石蕊试纸变红的气体 | |
| D. | 待检液加入盐酸可生成使澄清石灰水变浑浊的无色气体,则待检液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
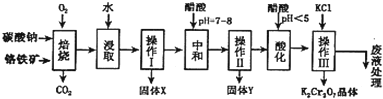
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com