
 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。 =1.5mol,所以转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024。
=1.5mol,所以转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:不详 题型:填空题
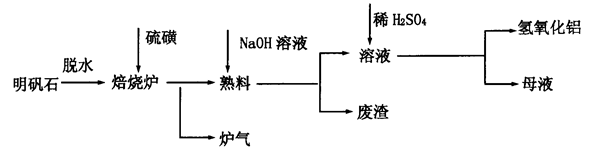
 和冰晶石(
和冰晶石( )混合熔融电解制得。
)混合熔融电解制得。 和
和 等。从铝土矿中提炼
等。从铝土矿中提炼 的流程如下:
的流程如下:
 )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下:
 生成的沉淀是___________,反应2的离子方程式为____ ___________________
生成的沉淀是___________,反应2的离子方程式为____ ___________________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
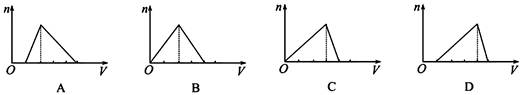
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C.还原amol Fe2O3所需H2、Al、CO的物质的量之比为3:2:3 |
| D.明矾属于硫酸盐,含结晶水,是混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝合金的熔点比纯铝高 | B.铝合金的硬度比纯铝小 |
| C.镁铝合金腐蚀时,镁先于铝被腐蚀 | D.常温下可用铝制容器盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
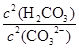 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
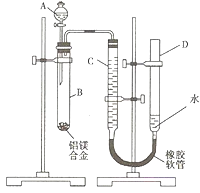
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.2:3 | C.3:2 | D.1:6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al(OH)3 → Al2O3 | B.Al2O3 → Al(OH)3 |
| C.Al → AlO2- | D.Al3+ → Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com