
 .
.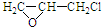 +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$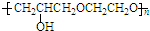 +nHCl
+nHCl .
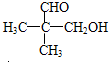
. 分析 有机物分子中N(H)=$\frac{102×9.8%}{1}$=10,故N(O)=$\frac{10}{5}$=2,则N(C)=$\frac{102-10-16×2}{12}$=5,故该有机物的分子式为C5H10O2,一定条件下,A与一定氢气反应生成B,A含有不饱和键,B分子的结构可视为一个碳原子上连接两个甲基和另外两个结构相同的基团,则B为 ,故A为
,故A为 .
.
解答 解:(1)有机物分子中N(H)=$\frac{102×9.8%}{1}$=10,故N(O)=$\frac{10}{5}$=2,则N(C)=$\frac{102-10-16×2}{12}$=5,故该有机物的分子式为C5H10O2,
故答案为:C5H10O2;
(2)①一定条件下,A与一定氢气反应生成B,A含有不饱和键,B分子的结构可视为一个碳原子上连接两个甲基和另外两个结构相同的基团,则B为 ,反应为
,反应为 →
→ ,则A为
,则A为 ,
,
故答案为: ;
;
②A中含有-CHO,能发生还原反应,含有-OH,能发生取代、酯化反应,由于相邻C原子上没有H原子,则不能发生消去反应,
故答案为:b.
③B为 ,能与环氧氯丙烷发生类似信息反应生成高聚物,则该高聚物的结构简式为:
,能与环氧氯丙烷发生类似信息反应生成高聚物,则该高聚物的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物分子式的确定、有机物官能团的结构和性质,题目难度中等,本题易错点为(2),注意结构简式的推断,熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:推断题
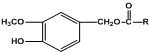 (R为烃基).其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基).其中一种辣椒素酯类化合物J的合成路线如下:

 .
. .
.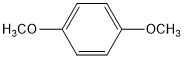 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
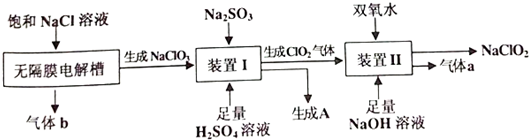


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
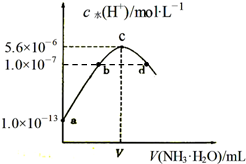 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | 由图可知稀硫酸的浓度为0.1 mol•L-1 | |
| B. | b点溶液pH=7 | |
| C. | c点所示溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | d点所示溶液中:c(NH4+)=2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 根据原子核外电子排布的特点,Zn在周期表中属于ds区元素 | |
| B. | P4和CH4都是正四面体形分子且键角都为109°28′ | |
| C. | NH3分子中N原子和H2O分子中O原子的杂化类型不相同 | |
| D. | 原子间只通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 0.1 mol/L的氨水中加少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 常温下,0.1 mol/L一元酸(HA)溶液的 pH=3,则该溶液中,c2(H+)=c(H+)×c(A-)+Kw | |
| C. | 向含有 1 mol KAl(SO4)2 的溶液中加入 Ba(OH)2 溶液得到沉淀的物质的量最多为 2 mol | |
| D. | 将 Ca(ClO)2、Na2SO3、FeCl3、NaAlO2 溶液蒸干均得不到原溶质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com