
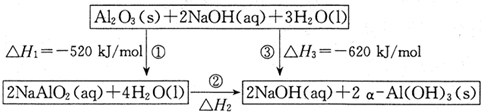
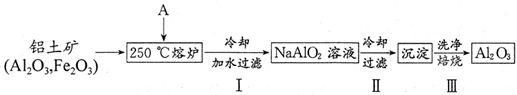
| 1 |
| 2 |
| ||
| ||
| ||
| 2700g |
| 27g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
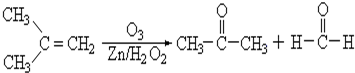
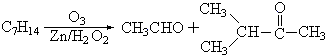
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁腐蚀时可能发生的正极反应:4OH--4e-→2H2O+O2↑ |
| B、明矾水解反应的离子方程式:Al3++3H2O→Al(OH)3+3H+ |
C、乙烯的结构式: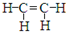 |
D、苯分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性KMnO4溶液、新制的Cu(OH)2悬浊液 |
| B、FeCl3溶液、金属钠、溴水、石蕊试液 |
| C、石蕊试液、溴水 |
| D、酸性KMnO4溶液、石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
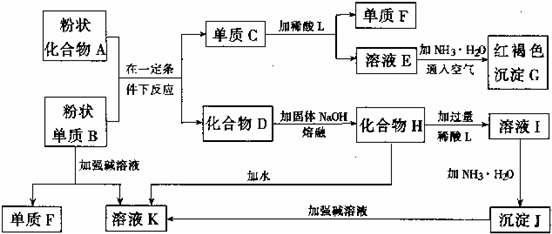
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com