
| A. | HF | B. | H20 | C. | H2S | D. | CH4 |
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2中含有的阴离子数为2 NA | |
| B. | 由H2O2制得2.24 L O2,转移的电子数目为0.4 NA | |
| C. | 常温常压下,8 g O2与O3的混合气体中含有4 NA个电子 | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
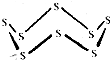 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 1mol KNO3参与该反应,转移电子总数目约为5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
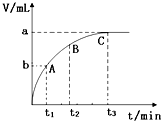 某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:
某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:| 实验序号 | 5%H2O2溶液 | 水 | 溶液温度 | 1mol/L FeCl3溶液 | 所用时间 |
| ① | 10.0ml | 0.0ml | 20℃ | 2滴 | t1 |
| ② | 9.0ml | 1.0ml | 40℃ | 2滴 | t2 |
| ③ | 5.0ml | Vx ml | 20℃ | 2滴 | t3 |
| ④ | 9.0ml | 1.0ml | 40℃ | 0 | t4 |
| ⑤ | 9.0ml | 1.0ml | 20℃ | 2滴 | t5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
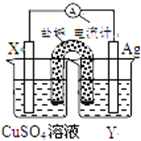 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
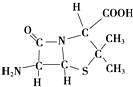 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
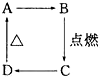 如图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸.C为无色无味的气体,能使石灰水变浑浊,D为一种酸,请填写以下空白.
如图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸.C为无色无味的气体,能使石灰水变浑浊,D为一种酸,请填写以下空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子中含有极性键和非极性键 | |
| B. | 向其溶液加入少量MnO2和FeCl3等能加快反应 | |
| C. | H2O2分子中所有原子都达8电子结构 | |
| D. | 该反应中H2O2是氧化剂也是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com