
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
【答案】 ![]() < a<b<c CO32->SO32- >CH3COO->HSO3- ①>②=③ CH3COOH(aq)
< a<b<c CO32->SO32- >CH3COO->HSO3- ①>②=③ CH3COOH(aq) ![]() CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol
CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol
【解析】(1)H2SO3的电离平衡常数K1的表达式:K1=![]() ;(2)CH3COOH的K=1.8×10-5,H2SO3的K1=1.5×10-2,说明亚硫酸强于醋酸,等pH两种酸,醋酸浓度大,当加蒸馏水稀释至1000mL时,醋酸电离出的氢离子多,pH更小些;(3)越稀越电离,则a、b、c三点溶液醋酸的电离程度由大到小为:a<b<c;(4)通过电离平衡常数分析可知,Ka越小,其阴离子越易结合氢离子,则CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为:CO32->SO32- >CH3COO->HSO3-;(5)c(H+)相同的①CH3COOH;②HCl二种酸溶液,酸浓度由大到小的关系是c(CH3COOH) >c(HCl),则体积相同的这两种别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是①>②,而体积相同、c(H+)相同的HCl、H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积是相等的,则由大到小的排列顺序是①>②=③;(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,此反应热中包含了H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol和CH3COOH(aq)
;(2)CH3COOH的K=1.8×10-5,H2SO3的K1=1.5×10-2,说明亚硫酸强于醋酸,等pH两种酸,醋酸浓度大,当加蒸馏水稀释至1000mL时,醋酸电离出的氢离子多,pH更小些;(3)越稀越电离,则a、b、c三点溶液醋酸的电离程度由大到小为:a<b<c;(4)通过电离平衡常数分析可知,Ka越小,其阴离子越易结合氢离子,则CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为:CO32->SO32- >CH3COO->HSO3-;(5)c(H+)相同的①CH3COOH;②HCl二种酸溶液,酸浓度由大到小的关系是c(CH3COOH) >c(HCl),则体积相同的这两种别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是①>②,而体积相同、c(H+)相同的HCl、H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积是相等的,则由大到小的排列顺序是①>②=③;(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,此反应热中包含了H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol和CH3COOH(aq) ![]() CH3COO-(aq) + H+(aq) ΔH=?,由盖斯定律可求得醋酸电离的反应热,则醋酸电离的热化学方程式为: CH3COOH(aq)
CH3COO-(aq) + H+(aq) ΔH=?,由盖斯定律可求得醋酸电离的反应热,则醋酸电离的热化学方程式为: CH3COOH(aq) ![]() CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol。
CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】收藏家收藏的清末铝制品,至今仍保存完好,其主要原因是
A. 铝不易发生化学反应 B. 铝的氧化物容易发生还原反应
C. 铝不易被氧气氧化 D. 铝表面致密的氧化膜能阻止铝进一步被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A. 通常状况下,NA个Cl2分子的质量是71g
B. 通常状况下,NA个C02分子的体积约是22.4L
C. 0.1 mol/L的H2S04溶液中H+的个数是0.2NA
D. 若lg N2含有m个分子,则NA=m/28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业上增大压强以提高反应物的转化率
B.黄绿色的氯水光照后颜色变浅
C.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q是合成某药品的中间体,其一种合成路线如下:
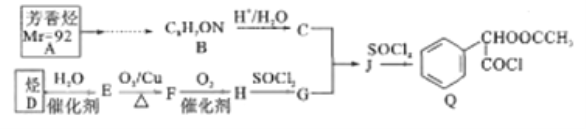
已知如下信息:
Ⅰ. 
Ⅱ. ![]()
回答下列问题:
(1)已知:在标准状况下,气体D的密度为1,25g/L,D能使溴的四氯化碳溶液褪色。D的名称是__;A的结构简式为_________
(2)C所含官能团名称是__;J![]() Q的反应类型是_______
Q的反应类型是_______
(3)Q的分子式为__________
(4)C和G反应生成J。写出化学方程式:__________
(5)M是J的同分异构体,M能发生水解反应且在核磁共报氢谱上有2组峰,峰的面积比为2:3,写出M所有可能的结构简式:___________
(6)设计由A为原料合成B的路线:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的正确说法是
A.聚乙烯可发生加成反应
B.石油干馏可得到汽油、煤油等
C.淀粉、蛋白质完全水解的产物互为同分异构体
D.乙酸乙酯、油脂与NaOH溶液反应均有醇生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图制取SO2并验证SO2性质的装置图。

已知Na2SO3+H2SO4=Na2SO4+SO2+H2O。
(1)①中为紫色石蕊试液,实验现象为________,实验证明SO2是________气体。
(2)②中为红色品红溶液,现象为________证,明SO2有________性。
(3)④为紫红色高锰酸钾,实验现象为________,证明SO2有________性。
(4)⑤的作用________,反应方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究,过程如下:
(1)调节pH,实验记录如下:
实验 | pH | 现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
I.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
II.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是____________________________。
②推测a中白色沉淀为Ag2SO4,推测的依据是_________________________________。
(2)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于_________溶液中,未溶解。
(3)将X从溶液中滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
II.向X中加入过量浓HNO3,产生红棕色气体
III.用Ba(NO3)2溶液、BaCl2溶液检验II中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是_________________________。
②根据上述现象,分析X的性质和元素组成是__________________________。
③II中反应的化学方程式是________________________。
(4)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,SO32-还原性增强,并通过进一步实验确认了这种可能性,实验装置如图所示:

①气体Y是__________________。
②白色沉淀转化为X的化学方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com