
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
分析 ①求出106gNa2CO3晶体的物质的量,然后根据1mol碳酸钠中含2mol钠离子和1mol碳酸根来分析;
②1molN2和3molH2的反应为可逆反应;
③Fe和稀硝酸反应方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;
④求出100gCaBr2 的物质的量,然后根据1mol溴化钙能消耗1mol氯气来分析.
解答 解:①106gNa2CO3晶体的物质的量为1mol,而1mol碳酸钠中含2mol钠离子和1mol碳酸根,故含3NA个离子,故错误;
②1molN2和3molH2的反应为可逆反应,故不能进行彻底,则容器中的分子数大于2NA个,故正确;
③Fe和稀硝酸反应方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,故当1mol稀硝酸反应完全时,所得溶液中硝酸根的物质的量为0.75NA个,故正确;
④100gCaBr2 的物质的量为0.5mol,而1mol溴化钙能消耗1mol氯气,故0.5mol溴化钙能消耗0.5mol氯气,故错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | Y位于元素周期表的第2周期第IVA族 | |
| B. | X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X | |
| C. | X、Z、W形成的盐中只含有离子键 | |
| D. | 产生刺激性气味气体的反应离子方程式为H++HSO3-=H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的CHCl3含有的分子数为0.5NA | |
| B. | 28gSi晶体中含有Si-Si键的个数为4NA | |
| C. | 常温下,78g某浓度的乙炔的苯溶液中含碳原子数为6NA | |
| D. | 0.1 molCnH2n+2中含有的碳碳单键数为0.1nNA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| 原子半径/nm | 0.154 | 0.130 | 0.071 |
| A. | 原子最外层电子数:Z>X>Y | B. | 三种元素可能为同周期元素 | ||
| C. | 原子序数:Y>X>Z | D. | 离子半径:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
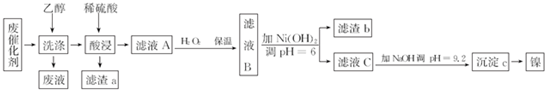
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示二氧化碳分子 可以表示二氧化碳分子 | |
| B. | S2-的结构示意图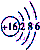 | |
| C. | 电子式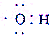 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 光气((COCl2)结构式: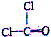 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
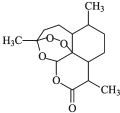 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H20O5 | B. | 具有较强的还原性 | ||
| C. | 易溶于水,乙醇和乙醚 | D. | 氧原子的化合价由-1和-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为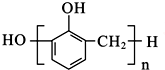 | |
| C. | 醋酸和硬脂酸互为同系物,C6H12和C9H18也一定互为同系物 | |
| D. | 迷迭香酸的结构为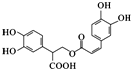 它可以发生酯化、水解但不能加成反应. 它可以发生酯化、水解但不能加成反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧RbH时,火焰有特殊颜色 | |
| B. | RbH中H+半径比Li+半径小 | |
| C. | 跟液氨反应时,有RbNH2生成 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com