
| A、热稳定性 |
| B、常温时的溶解度 |
| C、常温时同浓度的pH |
| D、与含1mol HCl的盐酸完全反应时所需的物质的量 |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
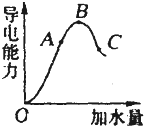 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| α |
| KW |
| A、NaOH |
| B、NaHSO4 |
| C、NH4NO3 |
| D、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
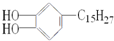 )是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂在物体的表面,在空气中干燥后变成黑色的漆膜.将漆酚放入下列物质中:①空气 ②溴水 ③小苏打溶液 ④氯化铁溶液 ⑤通入过量的二氧化碳,不能发生化学反应的是( )
)是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂在物体的表面,在空气中干燥后变成黑色的漆膜.将漆酚放入下列物质中:①空气 ②溴水 ③小苏打溶液 ④氯化铁溶液 ⑤通入过量的二氧化碳,不能发生化学反应的是( )| A、①②⑤ | B、③④ | C、②⑤ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、25℃时,若0.1mol/L氨水溶液中
| ||
B、25℃时,将0.1mol/L醋酸溶液加水稀释,保持温度不变,稀释过程中
| ||
| C、0.1mol/L的Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | ||
| D、浓度均为0.1mol/L的氨水溶液和NH4Cl溶液等体积混合后,若溶液呈碱性,则所得溶液中:c(NH4+)>c(NH3?H2O)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 事实 | 结论 |
| A.完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| B.灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C.在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 不能说明此盐不含碘 |
| D.甲乙两种物质,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b=2 |
| B、反应中转移的电子数一定为2NA |
| C、容器中一定没有残余的CO2和水蒸气 |
| D、a:b≥1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com