
| 选项 | 实际应用 | 化学知识原理 |
| A | 选用金属锂做锂电池的负极 | 锂轻且在空气中稳定 |
| B | 工业采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
| C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
| D | 在船身上装锌块来避免船体遭受腐蚀 | Zn比Fe活泼 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、金属锂有强还原性,易失电子,故做锂电池的负极;
B、合成氨正反应是气体积减小的反应;
C、盐碱地(含较多NaCl、Na2CO3)的碱性是由碳酸根的水解引起的;
D、锌比铁活泼,所以首先腐蚀的是锌.
解答 解:A、金属锂有强还原性,易失电子,故做锂电池的负极,而不是锂在空气中稳定,故A错误;
B、合成氨正反应是气体积减小的反应,所以加压有得平衡正向移动,向生成氨气的方向移动,故B正确;
C、盐碱地(含较多NaCl、Na2CO3)的碱性是由碳酸根的水解引起的,故加入石膏CaSO4•2H2O后,能将Na2CO3中的CO32-沉淀为碳酸钙,从而降低盐碱地的碱性,故C正确;
D、锌比铁活泼,所以首先腐蚀的是锌,起到保护锌的作用,故D正确;
故选A..
点评 本题考查了金属的电化学腐蚀和防护,难度不大,应注意的是金属的腐蚀主要是由电化学腐蚀中的吸氧腐蚀引起的.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:解答题
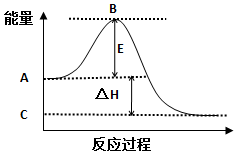
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硝酸中加入FeO:FeO+2H+═Fe2++H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
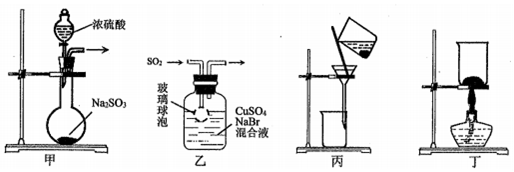
| A. | 用装置甲制取SO2 | B. | 用装置乙制取CuBr | ||
| C. | 用装置丙避光将CuBr与母液分离 | D. | 用装置丁干燥CuBr |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b+c时,B的物质的量分数变大 | B. | 若a=b+c时,B的体积分数不变 | ||
| C. | 若a>b+c时,A的转化率变小 | D. | 若a<b+c时,A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成塔中加入3molH2与1molN2反应即可得到2molNH3 | |
| B. | 工业上合成SO3时可加入过量空气以提高SO2的转化率 | |
| C. | 利用Al、Mg、NaOH溶液、导线及电流计等可证明Al的金属活动性大于Mg的 | |
| D. | 冰箱保存的食品不易变质,与化学反应速率无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
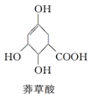
| A. | 分子中含有2种官能团 | |
| B. | 1mol莽草酸与Na反应最多生成4mol氢气 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com