
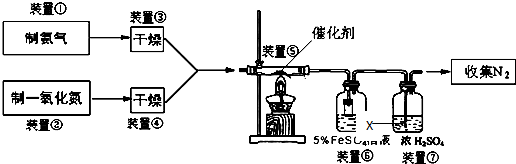

分析 (1)根据实验室制氨气可以选用加热氯化铵与氢氧化钙固体的固固加热型或加热浓氨水的加热液体型或者向氧化钙等固体中滴加浓氨水的固液不加热型,据此分析;
(2)装置③干燥氨气选择和氨气不反应、不能溶解氨气的干燥剂;装置④是干燥一氧化氮气体,干燥剂不选强氧化性物质;
(3)装置⑥中,粗玻璃管X的作用防止倒吸,装置⑦是用来除去未反应的氨气,及其干燥N2;
(4)根据二价铁与氨水发生反应生成氢氧化亚铁沉淀书写;
(5)依据6NO+4NH3=5N2+6H2O的化学方程式计算反应的一氧化氮,结合转化率概念分析计算得到.
解答 解:(1)加热氯化铵与氢氧化钙固体制氨气为固固加热型,所以选A,方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,实验室制氨气还可用加热浓氨水的加热液体型或者向氧化钙等固体中滴加浓氨水的固液不加热型,所以可用选BC,故答案为:A;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O; BC;
(2)装置③干燥氨气选择和氨气不反应、不能溶解氨气的干燥剂,装置④是干燥一氧化氮气体,干燥剂不选强氧化性物质,所以装置③、④若用同一装置,应选用碱性无强氧化性的物质即碱石灰,故选:D;
(3)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来除去未反应的氨气,并且干燥氮气;
故答案为:防止倒吸;除去未反应的氨气并干燥N2;
(4)因为二价铁与氨水发生反应生成氢氧化亚铁沉淀,方程式为:Fe2++2NH3+2H2O=Fe(OH)2↓+2NH4+,故答案为:Fe2++2NH3+2H2O=Fe(OH)2↓+2NH4+;
(5)若进入装置⑤的NO共2688mL(已折算为标准状况,下同)物质的量=$\frac{2.688L}{22.4L/mol}$=0.12mol,氨气过量,最后收集到标准状况下2016mL N2,物质的量=$\frac{2.016L}{22.4L/mol}$=0.09mol;6NO+4NH3=5N2+6H2O,依据反应化学方程式计算反应的一氧化氮物质的量=$\frac{6×0.09mol}{5}$=0.108mol,则NO的转化率=$\frac{0.108mol}{0.12mol}$×100%=90%;
故答案为:90%.
点评 本题考查了物质现在的实验验证和反应现象的判断应用,化学方程式的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(HCO${\;}_{3}^{-}$) | ||
| C. | c(H+)•c(OH-) | D. | $\frac{c(O{H}^{-})•c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中的离子方程式;Na+2H2O=Na++2OH-+O2↑ | |
| B. | 常温下,0.1mol/L氯化铵溶液pH=5的原因:NH4++H2O?NH3•H2O+H+ | |
| C. | 用惰性电极电解饱和食盐水的阳极反应式:2Cl--2e-=Cl2↑ | |
| D. | 乙醛与新制的氢氧化铜悬浊液反应的离子方程式:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | 糖类 | C. | 脂肪 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y,Z形成的分子空间构型可能是正四面体 | |
| B. | W,Y,Z的电负性大小顺序一定是Z>Y>W | |
| C. | WY2分子中δ键与π键的数目之比是2:1 | |
| D. | W,X,Y,Z的原子半径大小顺序可能是W>X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2900kJ | B. | 2680kJ | C. | 3120kJ | D. | 2856kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液中滴入KSCN后溶液变为血红色 | |
| B. | 将钠投入水中所得溶液中含有Na+,OH-和H2O分子 | |
| C. | 氯气溶解于水得到的氯水中既含有Cl2,H2O分子,又含有H+,Cl2,HClO等微粒 | |
| D. | 向硝酸银溶液中加入少量的铜粉,充分反应后往上层清夜中滴加KBr溶液呈浅黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
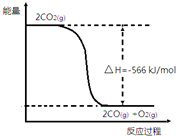 已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 如图可表示①反应过程中的能量变化 | |
| C. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 由②可知,反应生成Na2CO3固体106g,放出热量226kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com