
【题目】(1)已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是___________ (填序号)
①正反应速率一定大于逆反应速率
②反应物转化率一定增大
③生成物的产量一定增加
④反应物浓度一定降低
(2)下列溶液:①pH=1的盐酸,②0.05 molL-1的盐酸溶液 ③0.1molL-1的氯化钠溶液 由水电离的H+浓度由大到小顺序是___________(填序号)
(3)在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10molL-1. 该溶液的pH可能为_________________
(4)有等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是______________________
(5)一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是_______(填序号)
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是_______(填序号)
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
【答案】 ①③ ③②① 4或10 V3>V2=V1 ① ④ ⑤
【解析】本题主要考查化学平衡的移动。
(1)①正反应速率一定大于逆反应速率,故①正确;②反应物转化率不一定增大,故②错误;③生成物的产量一定增加,故③正确;④反应物浓度不一定降低,如纯液体和固体的浓度不变,故④错误。故选①③。
(2)水的电离受到HCl电离的H+的抑制,而且HCl电离的H+的浓度越大,对于水的电离的抑制程度越大。①c(H+)=01 molL-1,②c(H+)=0.05molL-1,③0.1molL-1的氯化钠溶液与纯水的电离程度相同,因此,由水电离的H+浓度由大到小的顺序是③②①。
(3)在25℃时,纯水电离产生的c(OH-)=10-7molL-1,某稀溶液中由水电离产生的c(OH-)=10-10molL-1<10-7molL-1,水的电离可能被酸、碱抑制,若被碱抑制,则该溶液的pH=10,若被酸抑制,则该溶液的pH=4,总之,该溶液的pH可能为10或4。
(4)Ba(OH)2、NaOH是强碱,完全电离出OH-,NH3·H2O为弱碱,其溶液中存在大量未电离的NH3·H2O,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系是V3>V2=V1。
(5)①正反应速率等于逆反应速率,故①是达到平衡状态的标志;②都是正反应速率,不能说明正反应速率等于逆反应速率,故②不是达到平衡状态的标志;③都是同一方向的反应速率,不能说明正反应速率等于逆反应速率,故③不是达到平衡状态的标志;④气体的物质的量随着反应进行而改变,混合气体的压强随之改变,当混合气体的压强不再改变时,说明反应达到平衡状态,故④是达到平衡状态的标志;⑤混合气体的颜色随着反应进行而改变,当混合气体的颜色不再改变时,说明反应达到平衡状态,故⑤是达到平衡状态的标志。故选①④⑤。


科目:高中化学 来源: 题型:
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_________;
(2)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。
2PbSO4 +2H2O。
铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(3)利用电解法可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。
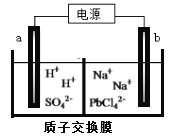
a电极的名称是__________,b电极的电极反应式为______________________
(4)PbO2可以通过石墨为电极电解Pb(NO3)2 和Cu(NO3)2的混合溶液制取。则阳极发生反应的电极反应式为______________,阴极上观察到的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究,已知FeCl3在100℃左右时升华 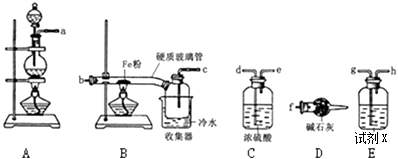
(1)装置的连接顺序为a→→→→→b→c→f
(2)装置D的作用;试剂X为 .
(3)硬质玻璃管与收集器之间没有用导管连接,原因是 .
(4)B中的反应开始前,需排除装置中的空气,应采取的方法是 .
(5)将所得FeCl3固体溶于水,则该溶液呈(填“中性”、“酸性”或“碱性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NO、CO2、N2O4三种气体,它们分别都含有0.5mol氧原子,则三种气体的物质的量之比为( )
A.1:1:2
B.1:1:1
C.4:2:1
D.1:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是合成聚碳酸酯的过程(PC)(反应条件和部分产物未写出):

信息提示:苯酚分子中与酚羟基直接相连的碳原子的邻、对位上的氢原子有很好的反应活性,易跟某些含羰基的化合物![]() (R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水。苯酚还能发生如下反应生成有机酸酯:
(R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水。苯酚还能发生如下反应生成有机酸酯:

请写出:
(1)X的结构简式____________。
(2)在一定条件下X与COClCl反应合成聚碳酸酯的化学方程式_________。
(3)X和浓溴水反应时,1 mol X最多能消耗Br2________mol。
(4)与乙酸苯酚酯分子式相同,分子中含有苯环且属于酯的其他可能有机物的结构简式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定不能大量共存的是
①能使红色石蕊试纸变蓝的溶液中:Na+ 、K+、CO![]() 、NO
、NO![]() 、[Al(OH)4]-
、[Al(OH)4]-
②c(H+)=0.1 mol·L-1的溶液中:Cu2+、Al3+、SO![]() 、NO
、NO![]()
③能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH![]() 、S2-、Br-
、S2-、Br-
④由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO![]()
⑤加入铝粉能产生氢气的溶液中:NH![]() 、Fe2+、SO
、Fe2+、SO![]() 、NO
、NO![]()
⑥含有大量Fe3+的溶液中:NH![]() 、Na+、Cl-、SCN-
、Na+、Cl-、SCN-
A. ①②③ B. ①③⑥
C. ③④⑤⑥ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质相互作用时,若改变反应条件或改变它们的用量,对生成物种类没有影响的是 ( )
A.Na2O2与CO2B.Ca(OH)2与CO2C.Na与O2D.C与O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(AgC1)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是
A. 向同浓度的Na2CrO4和NaC1混合溶液中滴加AgNO3溶液,AgCl先析出
B. 向AgCl饱和溶疲中加入NaCl晶体,有AgCl析出且溶液中cCl-)=c(Ag+)
C. AgCl和Ag2CrO4共存的悬浊液中, 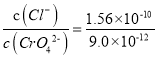
D. 向Ag2CrO4悬池液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com