
| A. | 保持温度和体积不变,加入少许N2O4,再达到平衡时,颜色变深 | |
| B. | 保持温度和体积不变,加入少许NO2,将使正反应速率减小 | |
| C. | 保持温度不变,增大压强时,将使正反应速率增大,逆反应速率减小 | |
| D. | 保持体积不变,升高温度,再达平衡时颜色变浅 |
分析 增大浓度、压强,反应速率均增大,该反应为吸热反应,升高温度平衡正向移动,以此来解答.
解答 解:A.保持温度和体积不变,加入少许N2O4,再达到平衡时,NO2的浓度比原平衡时浓度大,则颜色变深,故A正确;
B.保持温度和体积不变,加入少许NO2,生成物浓度增大,将使正反应速率比原平衡时速率大,故B错误;
C.保持温度不变,增大压强时,将使正反应速率、逆反应速率均增大,故C错误;
D.该反应为吸热反应,保持体积不变,升高温度,平衡正向移动,再达平衡时颜色变深,故D错误;
故选A.
点评 本题考查化学平衡的影响因素,为高频考点,把握温度、浓度、压强对反应速率及平衡的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
| 原子半径 | 电负性 |
| Al>Si | N<O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

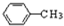 .
. .
.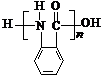 的单体.
的单体.
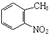 ,试剂a为酸性高锰酸钾溶液.
,试剂a为酸性高锰酸钾溶液.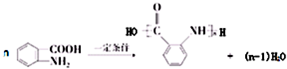 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
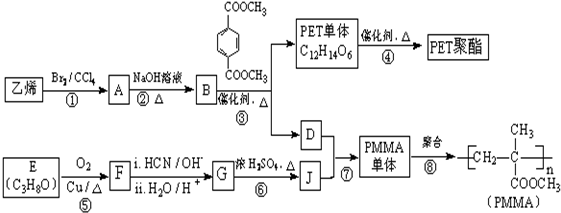
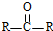 $→_{H_{2}O/H+}^{i.HCN/OH-}$
$→_{H_{2}O/H+}^{i.HCN/OH-}$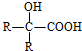 (R、R′代表烃基)
(R、R′代表烃基)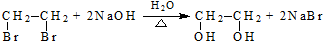
 .
.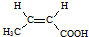 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lNA | B. | 2NA | C. | 3NA | D. | 0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
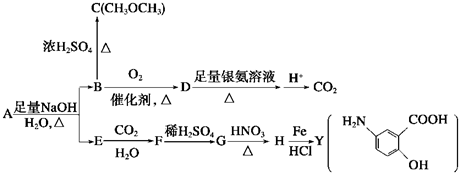
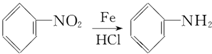
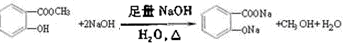 .
.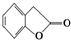 和
和 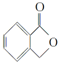 ,鉴别I和J的试剂为FeCl3或浓溴水.
,鉴别I和J的试剂为FeCl3或浓溴水.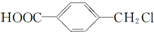 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:
制得,写出K在浓硫酸作用下生成的聚合物的结构简式: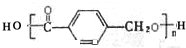 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com