
| A. | 生成15.68LN2(标准状况) | |
| B. | 有0.1molKNO3被氧化 | |
| C. | 转移电子的物质的量为0.25mol | |
| D. | 被氧化的N原子的物质的量为1.5mol |
分析 该反应中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以叠氮化钠是还原剂、硝酸钾是氧化剂,根据原子守恒知,氧化产物与还原产物的物质的量之比为30:2=15:1,若氧化产物比还原产物多0.7mol,则生成N2为0.7mol×$\frac{16}{14}$=0.8mol,转移电子的物质的量为0.7mol×$\frac{10}{14}$=0.5mol,被氧化的N原子的物质的量为0.7mol×$\frac{30}{14}$=1.5mol,以此解答该题.
解答 解:该反应中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以叠氮化钠是还原剂、硝酸钾是氧化剂,根据原子守恒知,氧化产物与还原产物的物质的量之比为30:2=15:1,若氧化产物比还原产物多0.7mol,则生成N2为0.7mol×$\frac{16}{14}$=0.8mol,转移电子的物质的量为0.7mol×$\frac{10}{14}$=0.5mol,被氧化的N原子的物质的量为0.7mol×$\frac{30}{14}$=1.5mol,
A.标况下氮气的体积为0.8mol×22.4L/mol=17.92L,故A错误;
B.KNO3中N元素的化合价降低,被还原,故B错误;
C.转移电子的物质的量为0.7mol×$\frac{10}{14}$=0.5mol,故C错误;
D.被氧化的N原子的物质的量为1.5mol,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化产物与还原产物的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 浓酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸稀溶液 | |
| C. | 在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 | |
| D. | 不得点燃添满酒精的酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层的电子数随核电荷数的增加而增多 | |
| B. | 单质颜色随核电荷数的增加而加深 | |
| C. | 氢化物的稳定性随核电荷数的增加而减弱 | |
| D. | 非金属性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I->Fe2+>Cl->SO2 | B. | Cl2>Fe3+>I2>SO2 | C. | Fe2+>I->Cl->SO2 | D. | Cl2>Fe3+>SO2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
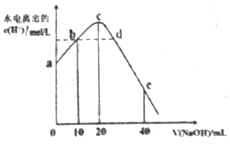 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | a、d对应的纵坐标数值分别是:>10-12、>10-7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com