
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | HY | C. | Y2 O | D. | O2 |
查看答案和解析>>
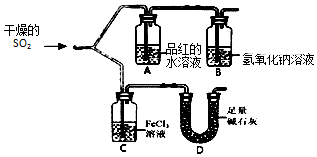
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,由水电离出c(OH-)=1×10-12 mol•L-1的溶液中:K+、HCO3-、Na+、Cl- | |
| B. | 含有0.1 mol•L-1 Fe2+的溶液中:NH4+、SO42-、H+、NO3- | |
| C. | 使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 室温下,pH=1的溶液中:Na+、Cl-、K+、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②④ | B. | 只有③④ | C. | 只有②③④ | D. | 均有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体都约是22.4L | |
| B. | 1mol气态物质,当体积约为22.4L时,该气体一定处于标准状况下 | |
| C. | 在标准状况下,2mol酒精(CH3CH2OH)的体积为44.8L | |
| D. | 常温常压下,质量为32g的O2含有的原子数为2NA |
查看答案和解析>>
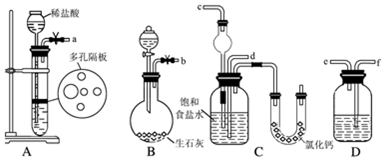
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
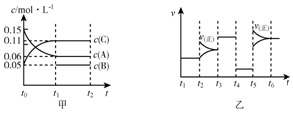 向某密闭容器中加入0.15mol/A、0.05mol/LC和一量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05mol/L].乙图中t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.
向某密闭容器中加入0.15mol/A、0.05mol/LC和一量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05mol/L].乙图中t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.| T1~t2 | T3~t4 | T4~t5 | T6~t |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族的元素从上到下金属性逐渐减弱 | |
| B. | 元素最高价氧化物水化物酸性越强,则对应元素非金属性越强 | |
| C. | 同一周期从左到右,元素原子半径逐渐增大 | |
| D. | 非金属元素的最高正化合价等于它的负化合价的绝对值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com